



国家纳米科学中心陈春英院士团队ACS Nano: 自修复水凝胶鼻喷疫苗激发对呼吸道病毒的保护性免疫
鼻粘膜疫苗激发保护性免疫反应以预防呼吸道病原体的早期侵袭、复制和传播。然而,通过鼻粘膜屏障的有效抗原递送以及增强强烈的全身和粘膜免疫反应仍然是鼻粘膜疫苗开发中的挑战。在这里,中国科学院大学陈春英/王亚玲/戴连攀描述了一种通过精确调节天然药物大黄素与铝离子之间的自组装过程,具有可逆应变依赖性溶胶-凝胶转变的鼻内给药自修复水凝胶疫苗。这种高生物粘附性的水凝胶疫苗通过将抗原限制在鼻粘膜表面,作为“粘膜口罩”,增强了抗原的稳定性并延长了其在鼻腔和肺部的停留时间。水凝胶还刺激了卓越的免疫增强特性,包括抗原内吞、交叉呈递和树突状细胞成熟。此外,该配方招募免疫细胞到鼻粘膜和鼻相关淋巴组织(NALT),同时增强了抗原特异性的体液、细胞和粘膜免疫反应。我们的发现为制备针对传染病或癌症的鼻粘膜疫苗提供了一种有前景的策略。该研究题为“Injectable Hydrogel Mucosal Vaccine Elicits Protective Immunity against Respiratory Viruses”发表在《ACS Nano》
图1展示了一种新型的鼻内免疫策略,即使用具有可逆应变依赖性溶胶-凝胶转变特性的自修复水凝胶疫苗(RAgel-RBD疫苗)来激发针对呼吸道病毒的保护性免疫。该疫苗通过精确调控天然药物大黄素与铝离子之间的自组装过程,形成一种高度生物粘附性的水凝胶,能够在鼻粘膜表面形成“粘膜口罩”,从而增强抗原的稳定性并延长其在鼻腔和肺部的停留时间。此外,RAgel-RBD疫苗还能够刺激包括抗原内吞、交叉呈递和树突状细胞成熟在内的卓越免疫增强效应,并招募免疫细胞到鼻粘膜和鼻相关淋巴组织(NALT),同时增强抗原特异性的体液、细胞和粘膜免疫反应。这些特性使得RAgel-RBD疫苗成为一种有前景的策略,用于制备针对传染病或癌症的鼻内疫苗。
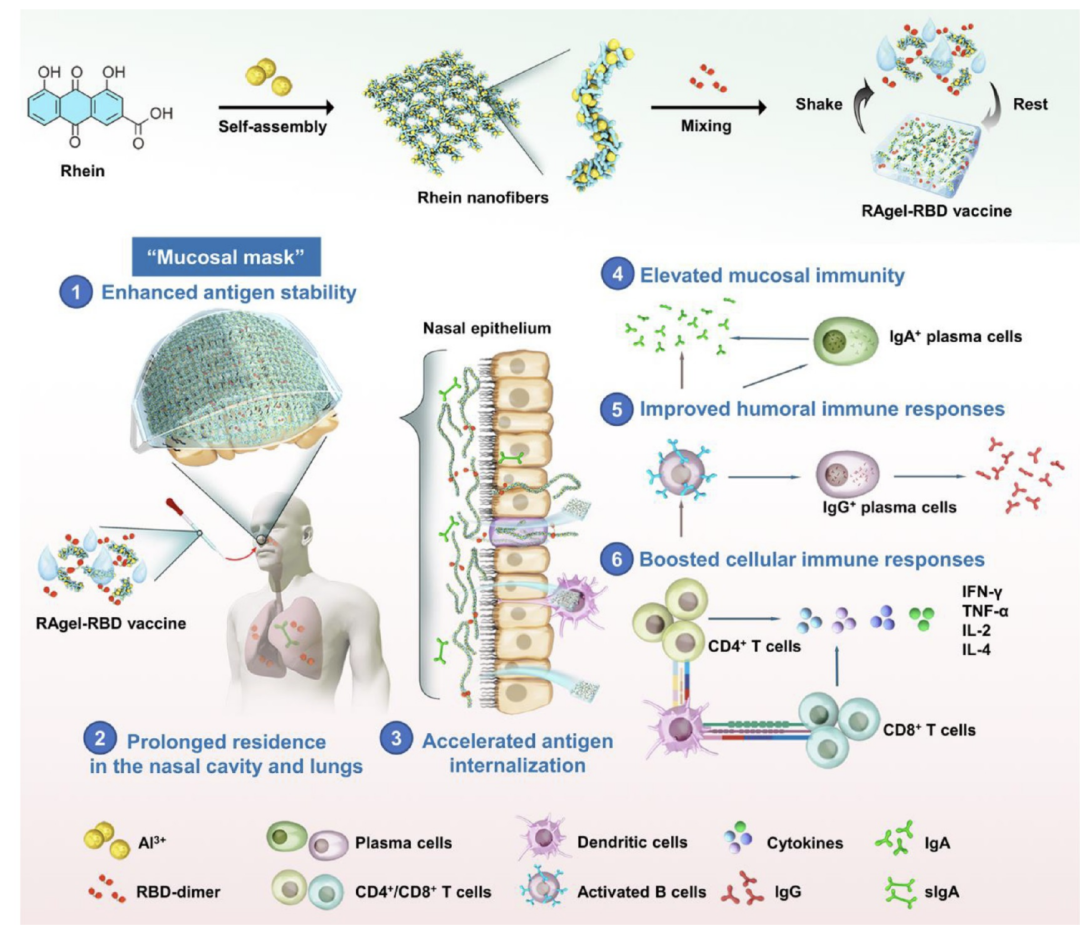
图1.通过RAgel-RBD疫苗进行鼻内免疫接种的示意图
【RAgel的设计和表征】
图2描述了自修复水凝胶(RAgel)的设计和特征,展示了其在不同条件下的形态和力学性能。通过光学图像、透射电子显微镜(TEM)和扫描电子显微镜(SEM)图像,观察到RAgel具有均匀的网络结构和纳米纤维特征。通过流变学测试,包括应变扫描和频率扫描,证实了RAgel具有剪切稀化的性质和稳定的力学性能,这表明RAgel能够在注射或喷洒到鼻腔后迅速形成一层薄膜。此外,RAgel展现出自我修复的机械性能,能够在受到剪切应变后恢复到其原始的凝胶状态,这对于疫苗的有效递送和在体内的稳定性至关重要。这些结果表明,RAgel是一种具有潜力的载体,可用于开发新型的鼻内疫苗,以提高疫苗的生物利用度和免疫效果。
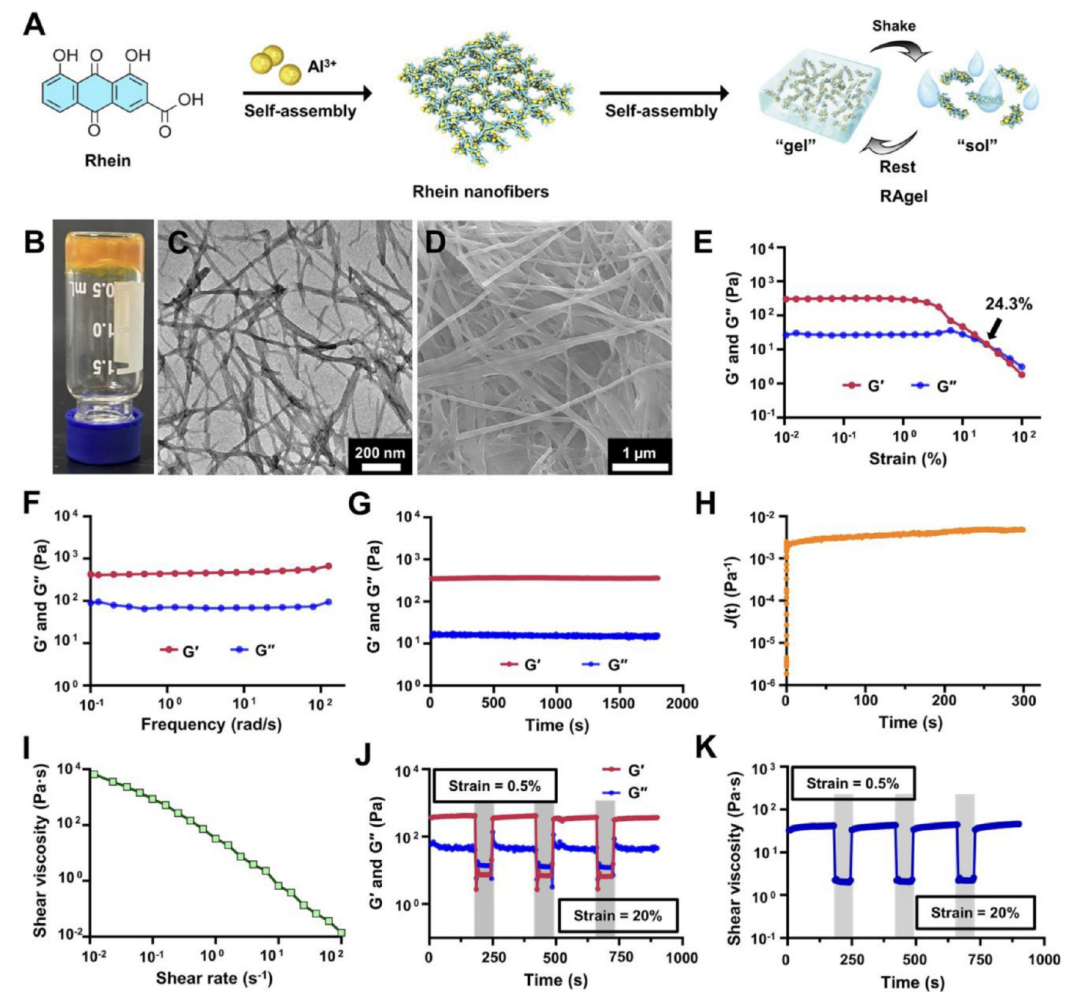
图2.RAgel的设计和表征
【Al3+调控的RAgel自组装机制】
图3阐述了RAgel自组装机制的研究,特别是Al3+离子如何调控大黄素分子间的相互作用及其组装过程。通过理论计算和实验验证,揭示了Al3+与大黄素分子之间的结合模式,以及这些相互作用如何导致稳定的水凝胶结构的形成。研究结果表明,Al3+离子与大黄素的羧基和酚羟基发生配位作用,形成稳定的片段分子,这些片段分子通过非共价相互作用如氢键和π-π堆积作用进一步组装成水凝胶。通过1H NMR离子滴定实验、等温滴定量热法、X射线衍射和小角X射线散射等技术,确认了Al3+在RAgel自组装过程中的关键作用,以及形成的水凝胶的纳米纤维结构。此外,电喷雾离子化质谱和傅里叶变换红外光谱分析进一步证实了RAgel中大黄素聚集体的稳定性和Al3+在水凝胶形成中的作用。
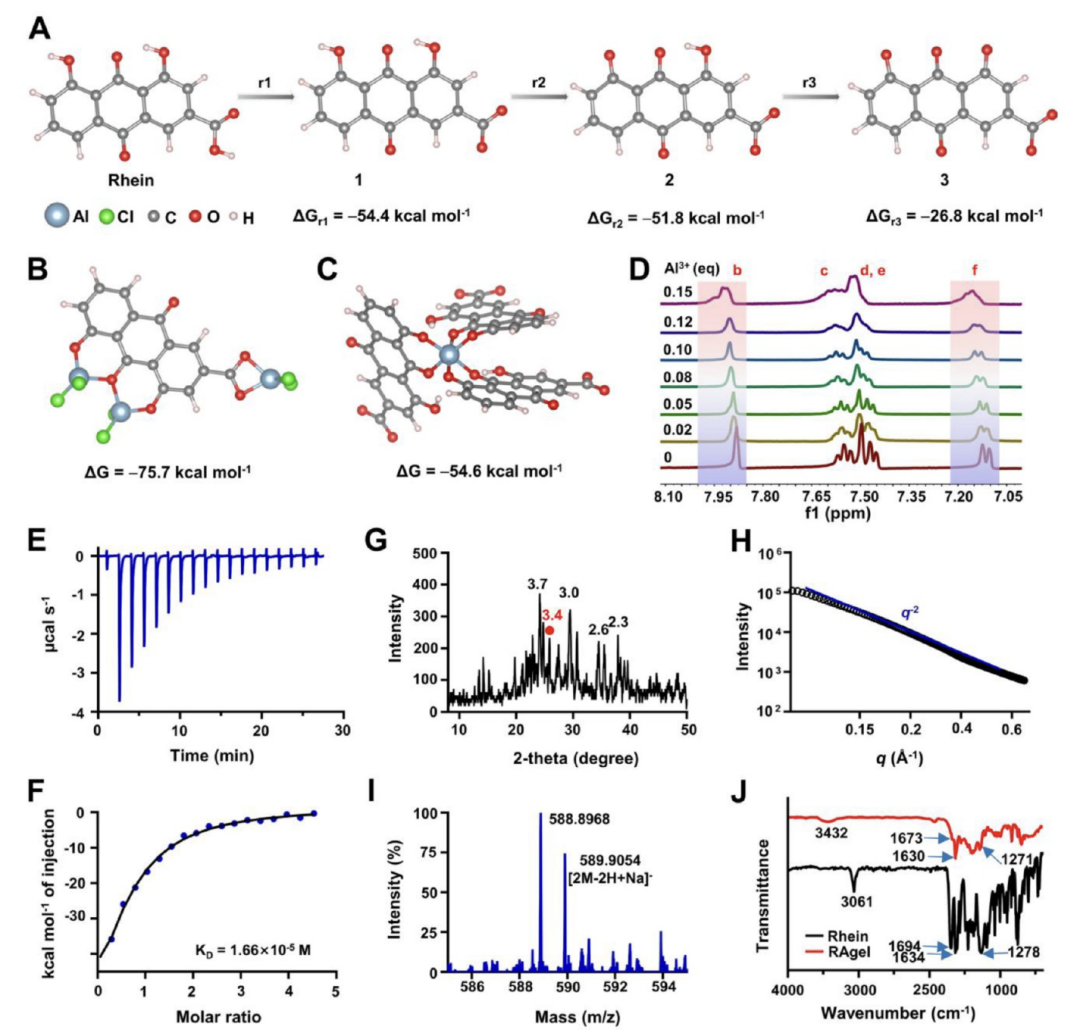
图3.Al3+调控的RAgel自组装机制
图4展示了RAgel-OVA疫苗在增强抗原稳定性和延长鼻粘膜停留时间方面的有效性,并通过体内外实验验证了其性能。通过体外释放实验,观察到OVA抗原从RAgel-OVA疫苗中的快速释放行为,这有助于疫苗快速激发免疫反应。同时,通过使用Cy5标记的OVA进行的体内 biodistribution 实验显示,与游离OVA相比,RAgel-OVA疫苗显著延长了抗原在鼻腔和肺部的停留时间,这表明RAgel疫苗能够有效地将抗原限制在粘膜表面,作为“粘膜口罩”发挥作用。此外,免疫荧光染色结果揭示了RAgel-OVA疫苗在鼻粘膜中促进了抗原的摄取和免疫细胞的共定位,这有助于提高疫苗的免疫原性。总体而言,这些结果表明RAgel-OVA疫苗是一种有效的鼻内疫苗递送系统,能够提高抗原的生物利用度和免疫效果,为开发新型粘膜疫苗提供了有力的支持。
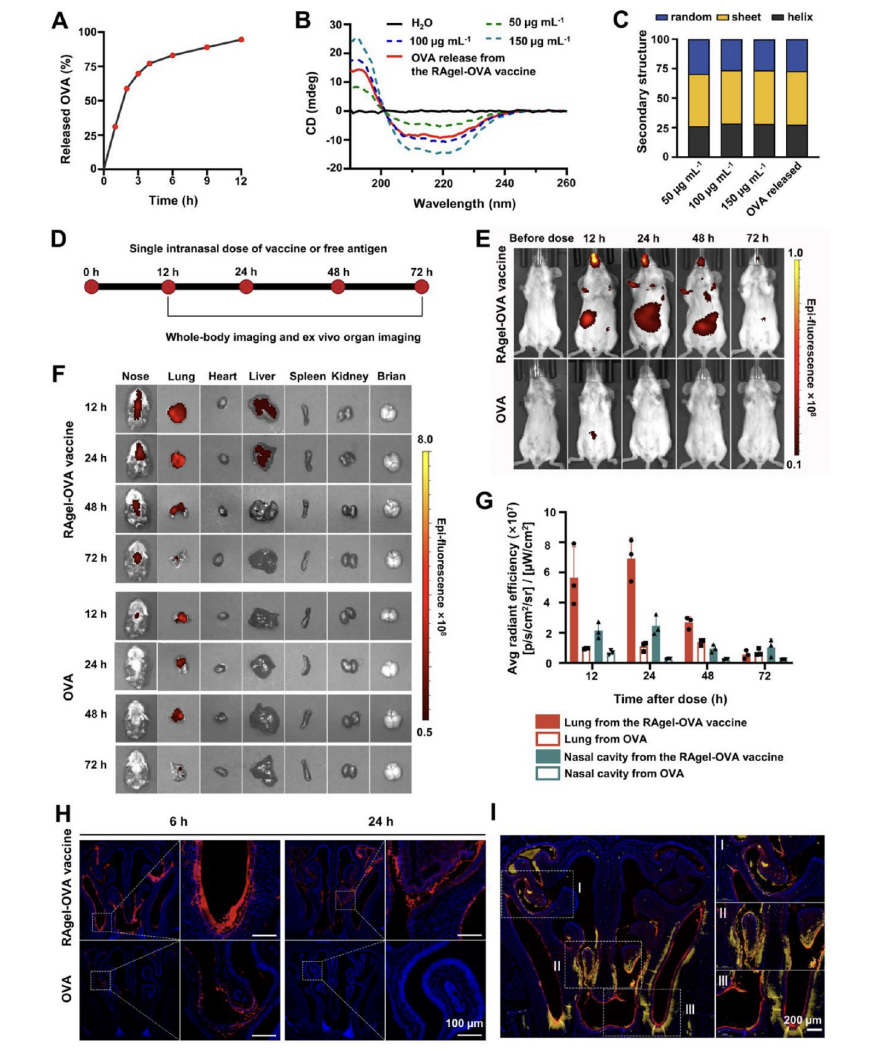
图4. RAgel-OVA疫苗增强了抗原稳定性,并在小鼠鼻内给药后促进抗原粘附于鼻粘膜
图5展示了RAgel-OVA疫苗在促进抗原摄取、交叉呈递以及抗原呈递细胞(APCs)激活和免疫细胞招募方面的能力。实验通过比较不同处理条件下BMDCs(骨髓来源的树突状细胞)的活化标志物CD80和CD86的表达水平,发现RAgel-OVA疫苗能够显著增强这些标志物的表达,表明其具有优异的免疫激活能力。此外,RAgel-OVA疫苗还能提升BMDCs中MHC I和MHC II的表达水平,这对于启动CD8+和CD4+ T细胞的免疫反应至关重要。共聚焦显微镜图像进一步证实了RAgel-OVA疫苗处理的BMDCs中抗原与溶酶体的显著共定位,指示抗原被APCs有效内吞并转运至溶酶体进行降解,从而促进T细胞反应的激活。同时,RAgel-OVA疫苗在鼻粘膜和NALT(鼻相关淋巴组织)中招募了包括B细胞、树突状细胞、巨噬细胞和T淋巴细胞在内的多种免疫细胞,这有助于形成局部炎症微环境并增强免疫应答。综合这些结果,RAgel-OVA疫苗不仅能够提高APCs的抗原摄取效率,还能够通过延长抗原在鼻粘膜的停留时间来创造有利于免疫细胞招募的环境,从而增强疫苗的免疫原性和保护效果。
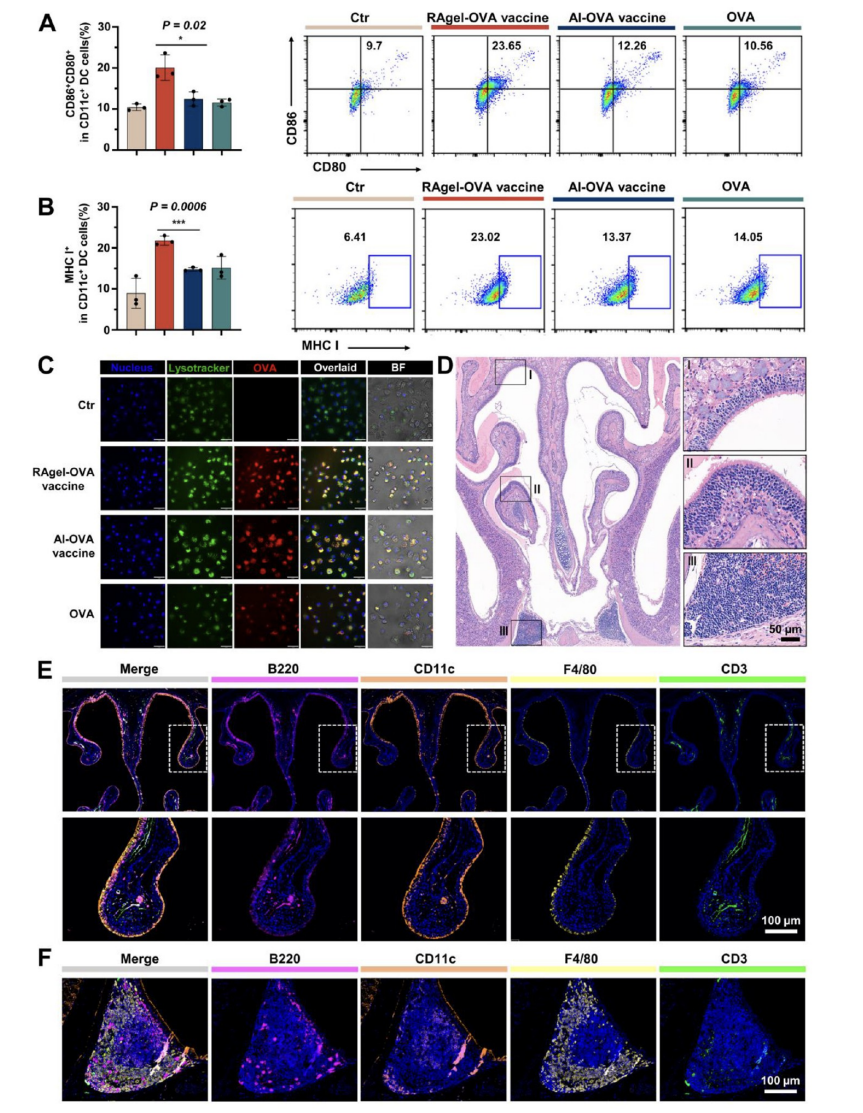
图5.RAgel-OVA疫苗促进抗原摄取、交叉呈递、抗原呈递细胞激活和免疫细胞招募
图6展示了使用RAgel-RBD疫苗进行鼻内免疫接种后,在小鼠体内激发的抗原特异性全身和粘膜免疫反应。研究中,小鼠通过鼻内途径接种了含有RBD-dimer抗原的RAgel-RBD疫苗,随后通过一系列的实验方法,包括抗体滴度测定、流式细胞术分析以及ELISPOT分析,评估了疫苗诱导的免疫反应。结果显示,RAgel-RBD疫苗能够有效诱导产生针对RBD抗原的特异性IgG抗体,并且在NALT中增加了生发中心B细胞的比例,这表明疫苗促进了抗原特异性的体液免疫反应。此外,疫苗还增强了记忆B细胞和记忆T细胞的产生,这些细胞对于长期的免疫保护至关重要。特别值得注意的是,RAgel-RBD疫苗在诱导粘膜免疫反应方面表现出色,显著提高了支气管肺泡灌洗液(BALF)中的sIgA水平,这是粘膜免疫保护的关键指标。此外,疫苗接种还增强了血清中对活SARS-CoV-2病毒及其Omicron亚型BA.2的中和能力。
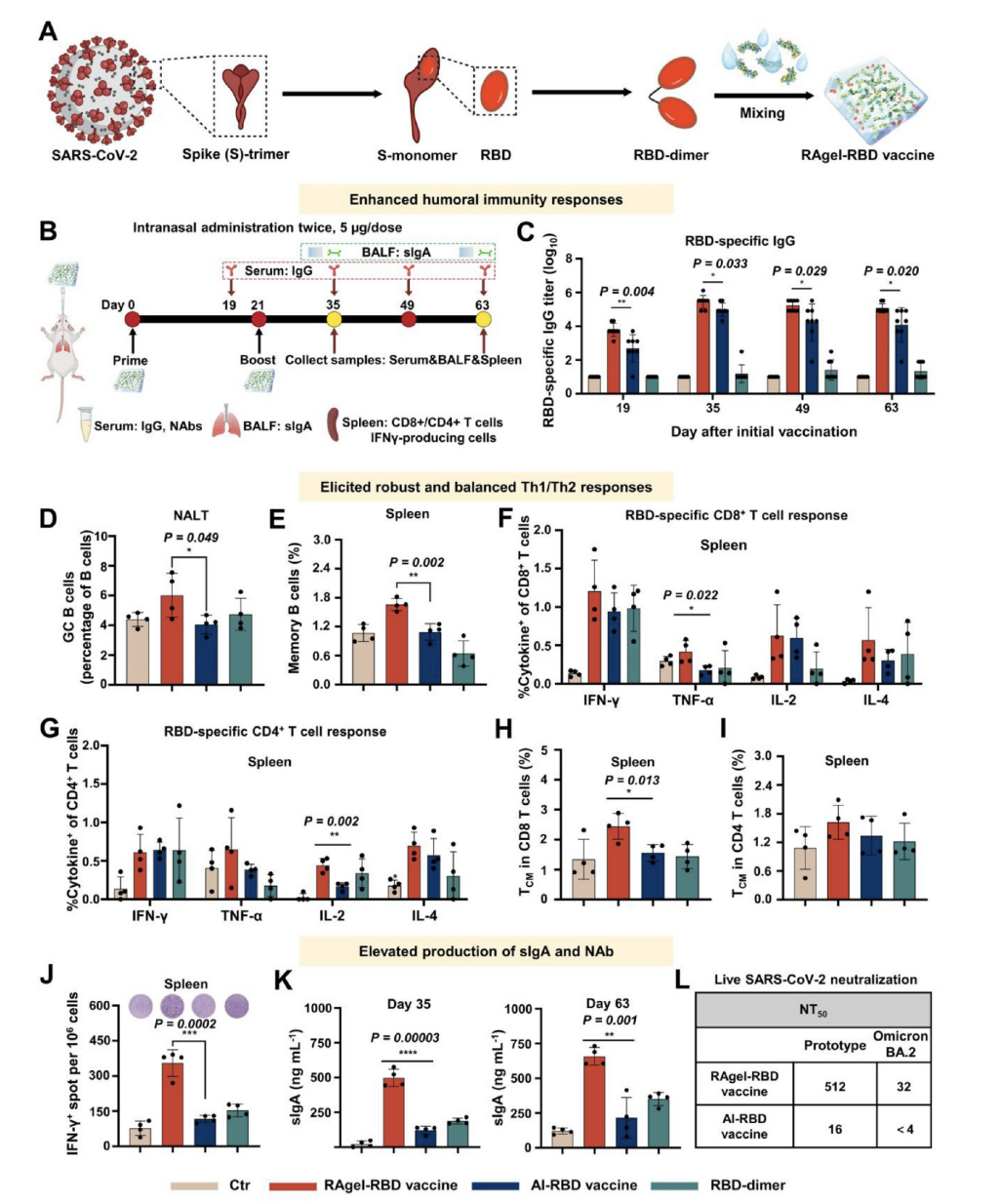
图6.RAgel-RBD疫苗通过鼻内免疫接种激发抗原特异性全身和粘膜免疫反应
【小结】
该研究开发了一种新型的自修复水凝胶疫苗平台,该平台能够有效地通过鼻内途径递送抗原,以激发针对SARS-CoV-2的保护性免疫反应。通过精确调控大黄素和铝离子之间的自组装过程,制备出的水凝胶疫苗在鼻腔内形成了稳定的“粘膜口罩”,显著提高了抗原的稳定性和在粘膜表面的停留时间,从而增强了抗原特异性的免疫反应。该疫苗不仅促进了抗原的摄取和交叉呈递,还激活了树突状细胞,并招募了免疫细胞到鼻腔粘膜和相关淋巴组织,激发了强烈的体液免疫、细胞免疫和粘膜免疫反应。此外,研究还证明了水凝胶疫苗在增强针对SARS-CoV-2及其变种的中和抗体产生方面具有显著效果。总体而言,这项研究为未来设计和开发针对传染病和癌症的鼻内疫苗提供了一种创新和有效的策略。