



赖氨酸特异性肽和蛋白质修饰策略被广泛用于研究电荷相关功能和应用。然而,这些策略往往会导致赖氨酸失去正电荷,严重影响蛋白质的电荷相关特性。在此,清华大学张洪杰团队报告了一种在水性条件下使用腈和羟胺保留正电荷并选择性地将赖氨酸侧链中的胺转化为酰胺的策略,为探索带正电荷蛋白质的特性提供了一条新途径。相关成果以“A Hydroxylamine-Mediated Amidination of Lysine Residues That Retains the Protein's Positive Charge”为题在《Angewandte Chemie, International Edition》上发表。
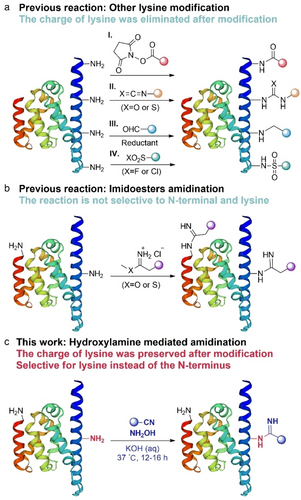
图1. 设计和表征 Nbs(包括 Nb21、7A3 和 TNF-VHH)工程纳米制剂的示意图
文章中的羟胺介导的酰胺化反应发生在水溶液中赖氨酸ϵ-NH2分子和各种腈类之间,并将这一策略应用于各种肽和蛋白质,取得了中等至优异的结果。通过利用脒基和衍生化反应基团的反应活性,文章展示了该反应的多种应用,包括铜催化的 C-N 交叉偶联反应和点击化学。此外,证实α-突触核蛋白和超电荷弹性蛋白(K-ELP)72 上的正电荷在修饰后都得以保留。基于这些结果,进一步探索了修饰蛋白质的正电荷相关性质和潜在应用,包括酰胺化 α-突触核蛋白的相行为和酰胺化 (K-ELP)72-DNA 纤维的机械性能。
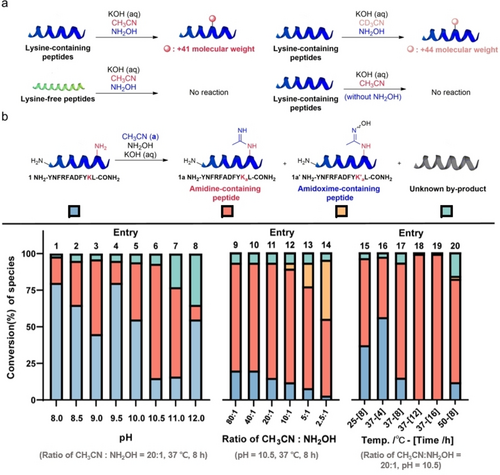
图2.羟胺介导的赖氨酸酰胺化反应的发展。
文章中的策略对未受保护的肽和蛋白质具有非常广泛的适用范围,含脒肽在通过两个不同的反应位点进行二次修饰时表现出良好的反应性。此外,带正电荷的弹性蛋白(K-ELP)72-DNA 纤维经(KAm-ELP)72-DNA 纤维修饰后,其机械性能(如拉伸强度和模量)也得到了提高。
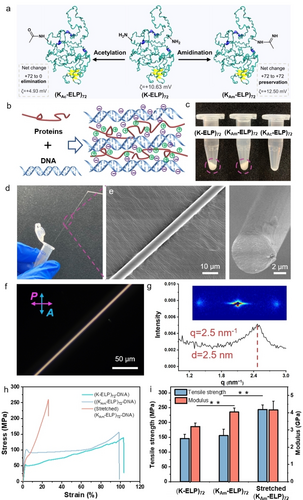
图3. 设计和表征 Nbs(包括 Nb21、7A3 和 TNF-VHH)工程纳米制剂的示意图。
总之,该研究成功修饰了各种未受保护的肽和蛋白质,而且转化率很高。此外,活性脒分子和衍生的修饰位点使后续的二次修饰成为可能。值得注意的是,正电荷在修饰过程中得以保留。因此,与正电荷相关的蛋白质特性,如α-突触核蛋白的液-液相分离行为,不会受到影响。上述优势使酰胺化策略成为研究含赖氨酸蛋白质正电荷相关特性和改变其性能的一种潜在工具。
https://onlinelibrary.wiley.com/doi/10.1002/anie.202402880