



由于成分和分层结构的复杂性,合成蛛丝纤维尚未达到与天然蛛丝相同的韧性和稳定性水平。特别是对蛛丝纤维中螺纹烷成分之间错综复杂的相互作用的理解仍是一个未知数。近日,清华大学张洪杰团队报告了由一个保守的C端蜘蛛丝模块、两个不同的天然β片模块和一个非蜘蛛丝随机线圈模块组成的仿蜘蛛丝纤维的模块化设计和制备。由此产生的纤维显示出 ~200 MJ/m3 的韧性,在已报道的人造蜘蛛丝中达到了最高值。相关成果以“Spidroin-mimetic Engineered Protein Fibers with High Toughness and Minimized Batch-to-batch Variations through β-sheets Co-assembly”发表在《Angewandte Chemie, International Edition》上。
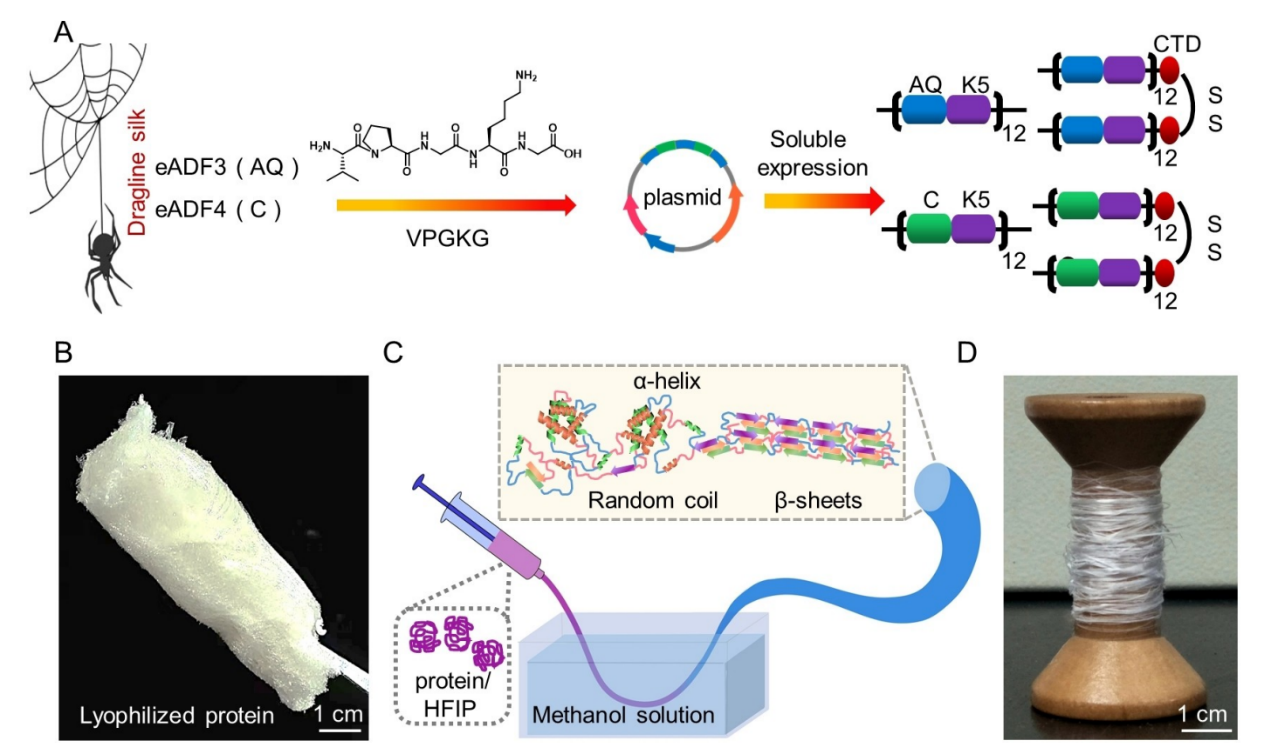
图1. 重组蛋白纤维的构建和生物合成示意图
受蛛丝组成的复杂性和不同来源的各种蛋白质模块性质的启发,文章报告了基于嵌合蛋白的超韧纤维,这些嵌合蛋白含有从ELP和天然蜘蛛丝中提取的序列。这些生物合成蛋白质纤维表现出 ~200 MJ/m3 的超强韧性,高于其他任何已报道的基于重组蛛丝蛋白的纤维。此外,由两种重组蛛丝蛋白制成的异种蛋白纤维,两种成分之间的相互作用促进了β片的分子间共同组装,从而提高了双组分蛛丝蛋白纤维的机械强度并减少了批次间的差异。其强度远高于任何单组分蛋白纤维,断裂强度提高了 80%。通过共价亚胺交联网络,蛋白质纤维的机械性能可得到进一步提高。值得注意的是,这些纤维还具有生物相容性和可编辑性。这些研究结果突显了可用于制造具有出色机械性能的蛋白质纤维的模块化策略。因此,上述工作提出了一种通用策略,用于开发高性能蛋白质纤维,在不同的应用场景中实现多样化的应用。

图2. 重组蛛丝纤维的机械性能和相应表征
这些发现为提高重组蛛丝纤维的性能提供了一种可行的方法,并为解释天然蛛丝机械性能的机理提供了启示。同时,双组分蛋白质纤维的生物相容性和可编辑性也得到了证实。通过精确调控重组蛋白的组装以及这些蛋白模块之间的相互作用,为开发具有优异机械性能和新型生物功能的纤维提供了可能的途径。与其他重组蛛丝系统形成鲜明对比的是,模块重组蛛丝蛋白很容易以可溶形式表达,从而简化了下游纯化步骤,提高了蛋白纯度。
https://onlinelibrary.wiley.com/doi/10.1002/anie.202400595