



铁死亡是一种受调节的细胞死亡途径,它提供了一种令人信服的方法来增强抗肿瘤免疫力,解决与免疫逃逸和与细胞凋亡抗性相关的免疫原性不足相关的挑战。近日,清华大学张洪杰团队报道了一种生物代谢MOF@COF纳米疫苗(NMCAH),旨在通过铁死亡介导的免疫刺激来激发自我放大的抗肿瘤反应。纳米疫苗展示了诱导活性氧生成和消耗肿瘤内谷胱甘肽、引发免疫原性铁死亡的能力。相关成果以“Ferroptosis-induced immunomodulation with biometabolic MOF@COF nanovaccine for self-boosting anti-tumor immunotherapy”发表在《Chemical Engineering Journal》上。
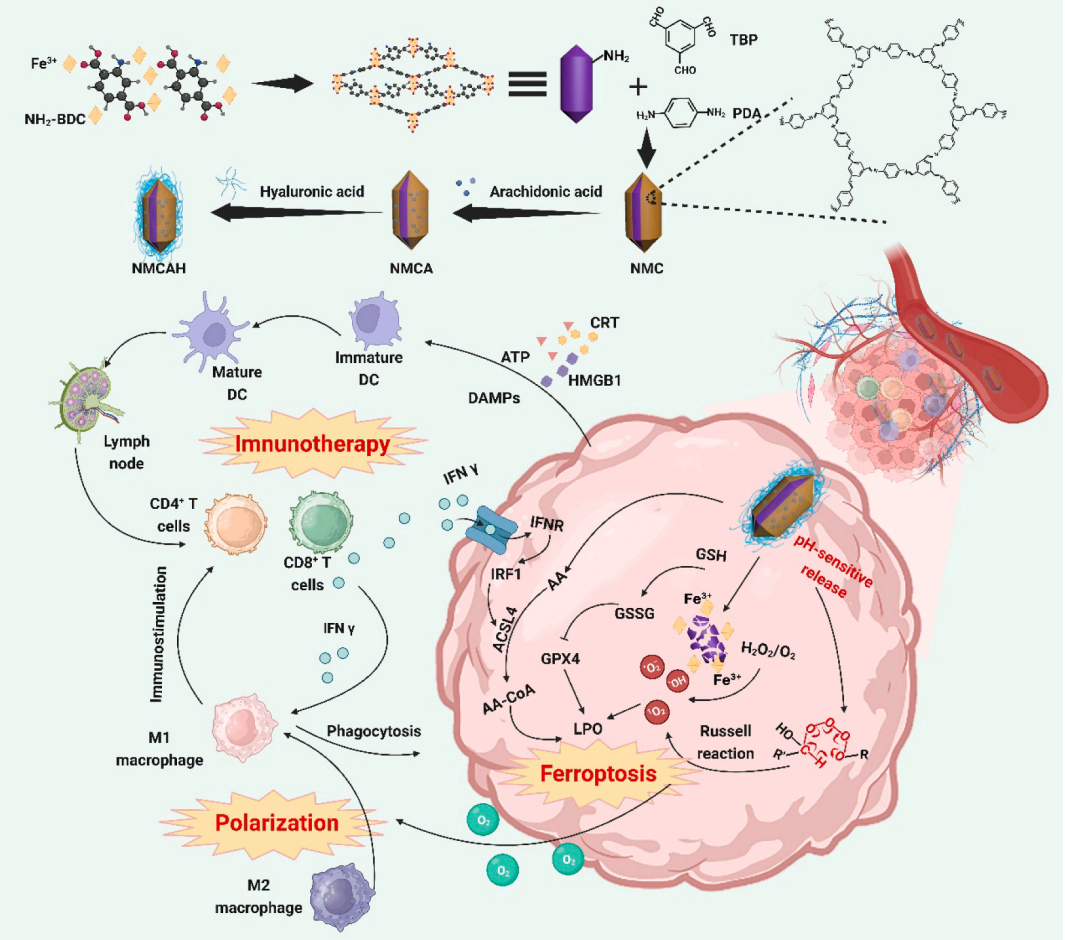
图1. NMCAH 的合成路线和治疗机制示意图
文章中构建了一种基于MOF@COF的、介导铁突变的免疫佐剂,该佐剂不仅能通过所设计的MOF@COF纳米结构引起免疫原性细胞铁突变,还能实现包括免疫原性铁突变、巨噬细胞极化和T细胞成熟在内的循环自身增强免疫反应。在此过程中,NMCAH 会发生酸响应降解,无论是 ROS 的产生还是 GSH 的消耗,都会促进 LPO 介导的铁变态反应,从而进一步引发宿主免疫反应,使活化的 CD8+T 细胞释放 IFN-γ。IFN-γ 和产生的 O2 都能诱导 M1 表型巨噬细胞的表 达,进而增加 T 细胞的浸润。同时,IFN-γ 可在外源性 AA 的辅助下诱导 ACSL4 介导的免疫性肿瘤铁凋亡,而 M1 表型巨噬细胞也可促进肿瘤细胞死亡。因此,基于MOF@COF的独特免疫佐剂充分利用了MOF和COF的结构特点,通过产生多种ROS、重塑免疫抑制性TME以及结合外源AA和IFN-γ,实现了循环自动增强免疫疗法,拓宽了有机MOF@COF的应用领域。
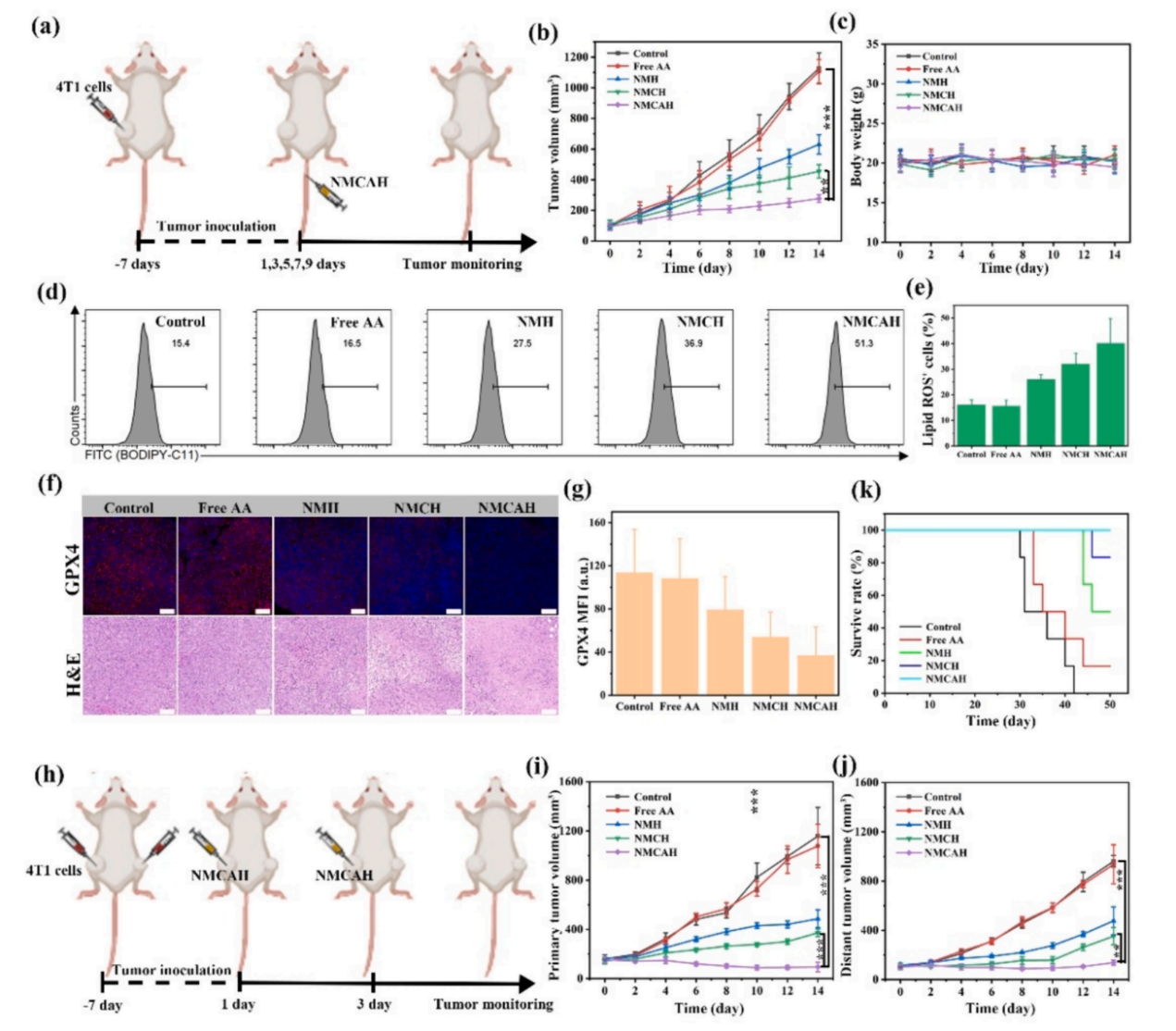
图2.肿瘤小鼠模型的建立和治疗示意图
铁死亡和适应性免疫之间这种错综复杂的协调相互作用为克服免疫抑制性肿瘤微环境带来了巨大的希望。该研究建立了一个多功能纳米治疗平台,通过利用调节细胞死亡的免疫原性特征来推进癌症免疫治疗。
https://linkinghub.elsevier.com/retrieve/pii/S1385894724041627