



近年来,恶性肿瘤的光动力疗法(PDT)研究取得了长足的进步,但如何将PDT扩展到第二个近红外窗口(NIR-II),并通过实时、准确的NIR-II荧光成像来确定药物富集状态,实现高疗效,仍是一项挑战。
在此,清华大学张洪杰团队开发了基于镧系元素纳米颗粒(Ln NPs)的纳米平台(LCR),提供了一种治疗纳米平台范例,既可用于实时荧光成像,也可在近红外-II 窗口内对原位乳腺肿瘤进行局部放疗。相关成果以“An Integrated Nanoplatform via Dual Channel Excitation for Both Precise Fluorescence Imaging and Photodynamic Therapy of Orthotopic Breast Tumor in NIR-II Region”发表在《Small》上。
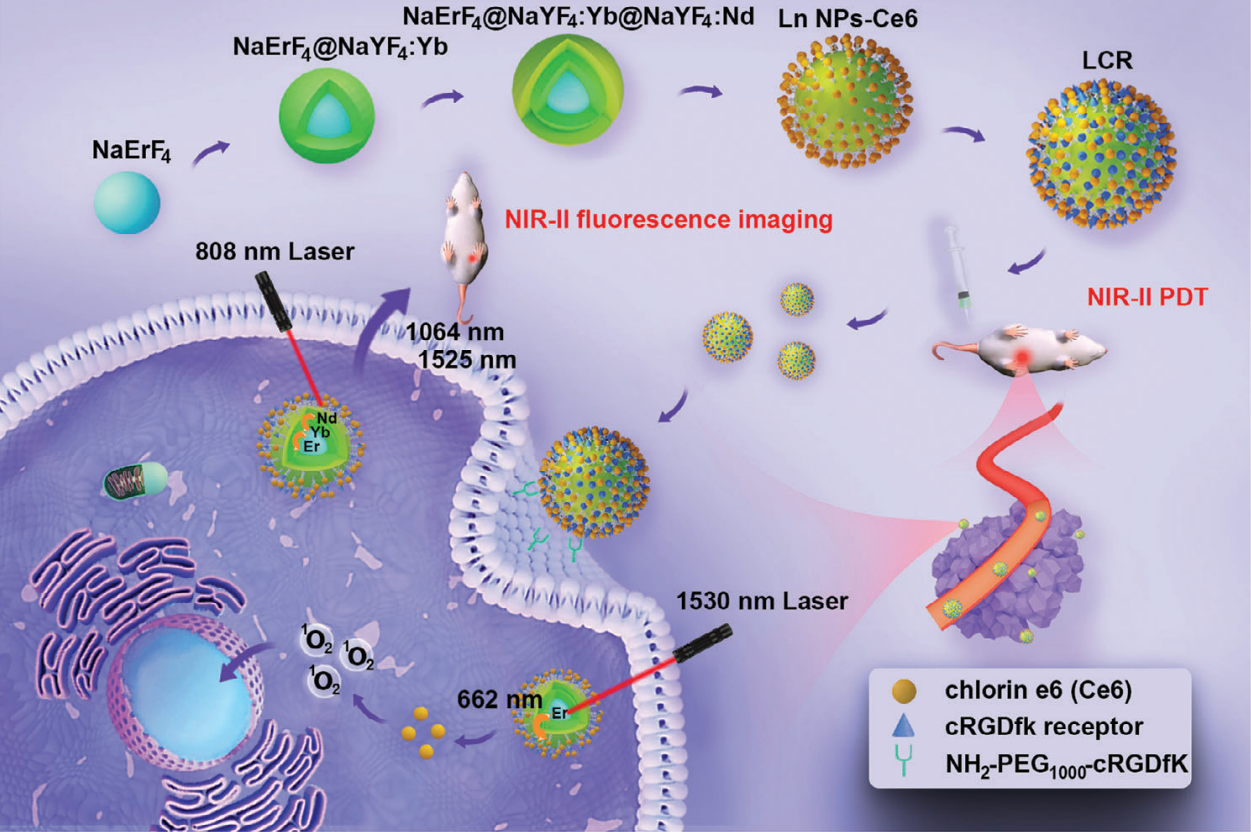
图1. 用于集成近红外-II 荧光成像和局部放疗的 LCR 制备示意图和功能图
在这项工作中,该平台主要包括三部分:荧光核(NaErF4@NaYF4:Yb@NaYF4:Nd, Ln NPs)、光敏剂(Chlorin e6)和靶向肽(NH2-PEG1000-cRGDfK),可通过双通道激发实现近红外II期光动力疗法(PDT)和近红外II期荧光成像。在808 nm激光的激发下,外层的Nd3+可以吸收能量并向内转移,发出以1064和1525 nm为中心的近红外-II荧光,进行高分辨率的近红外-II荧光成像,从而能够检测微小的肿瘤组织(≈3 mm)。此外,当转换为 1530 纳米激光激发时,Er3+ 内层的上转换发光也会产生,这可用于激活 Ce6,以进行局部放疗。通过利用双通道激发的发光性能,LCR 为精确诊断和高效治疗原位乳腺肿瘤提供了一种可行的策略。
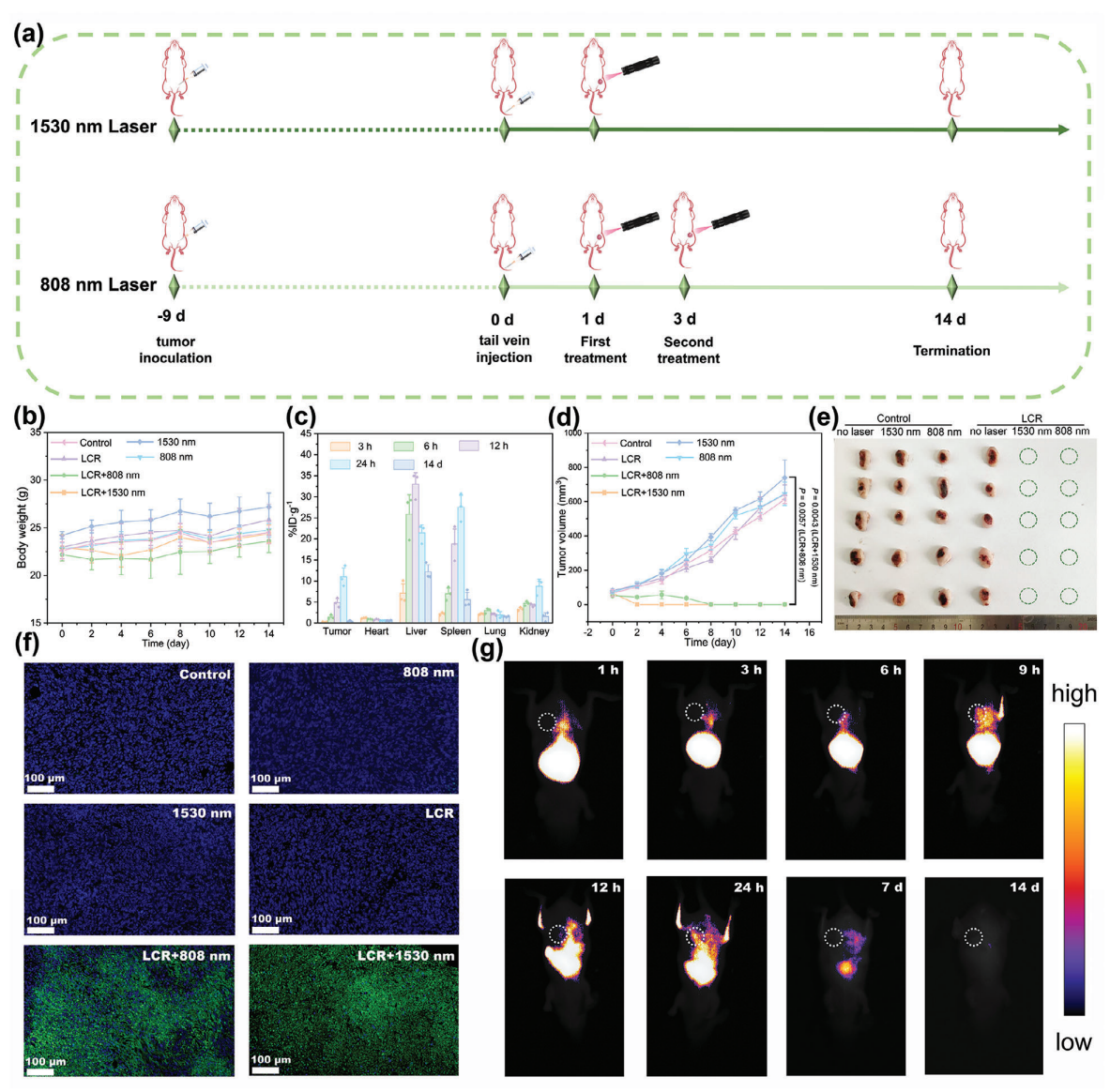
图2. 体内治疗示意图
总之,这项工作描述了一种创新的纳米平台,它利用双通道激发的不同发射模式,选择性地实现由近红外-II 光激发的光导放疗或近红外-II 发射(1064 和 1525 nm)的荧光成像。与近红外 I 光相比,1530 nm 光具有更强的组织穿透能力和更小的组织衰减能力,使 LCR 更适合于体内的光导治疗。这项工作提出了一种新的诊断和治疗一体化设计理念,通过结构复用最大限度地简化了材料结构,同时利用两种发光模式的优势实现了对肿瘤的高效诊断和治疗。
https://onlinelibrary.wiley.com/doi/10.1002/smll.202404007