



第一作者:Jiabin Wu、Xianyu Zhu
通讯作者:李亚栋、付强、晏亮
通讯单位:清华大学、安徽师范大学、中国科学院高能物理研究所、国家纳米科学与技术中心、中国科学技术大学
研究背景
1. 天然酶的辐射敏感性:天然酶暴露在X射线和γ射线下会因其结构变化而部分失活。水占生物组织的80%,射线电离水产生活性物质,这些物质会破坏天然酶的生化结构。
2. 纳米酶的优势与发展:纳米酶结合了生物催化剂和纳米材料的优势,具备成本低、稳定性高、易存储等特点。人工酶工程在原子和分子水平操控生物催化活性位点,从而设计出具有过氧化物酶等活性的纳米酶。
3. 单原子纳米酶及其优化:单原子纳米酶(SAzymes)通过优化几何结构和原子利用率增强酶活性。特别是CuN4-SAzymes具备高过氧化物酶活性,调整单Cu位点的配位数及其在碳材料上的支持,有望实现高酶活性和抗辐射性。
研究内容
1. CuN3-SAzyme 的高酶活性:CuN3-SAzyme通过调节单铜位点的配位环境,表现出比 CuN4-SAzyme 更高的过氧化物酶活性。密度泛函理论计算显示,CuN3活性基团优化了H2O2的吸附和解离。
2. 辐射增强与稳定性:X射线可以改善CuN3-SAzyme对H2O2分解的动力学。经过总剂量500 Gy的辐射后,CuN3-SAzyme的几何结构和配位环境无显著变化,仍保持高酶活性。
3. 临床应用前景:CuN3-SAzyme具有显著的抗辐射能力,可作为外部场增强的治疗剂用于体内外放射酶治疗。本研究为开发高酶活性和抗辐射能力的单原子酶提供了新范例。
图文解析
要点1:CuN3-SAzyme和CuN4-SAzyme的合成与表征。
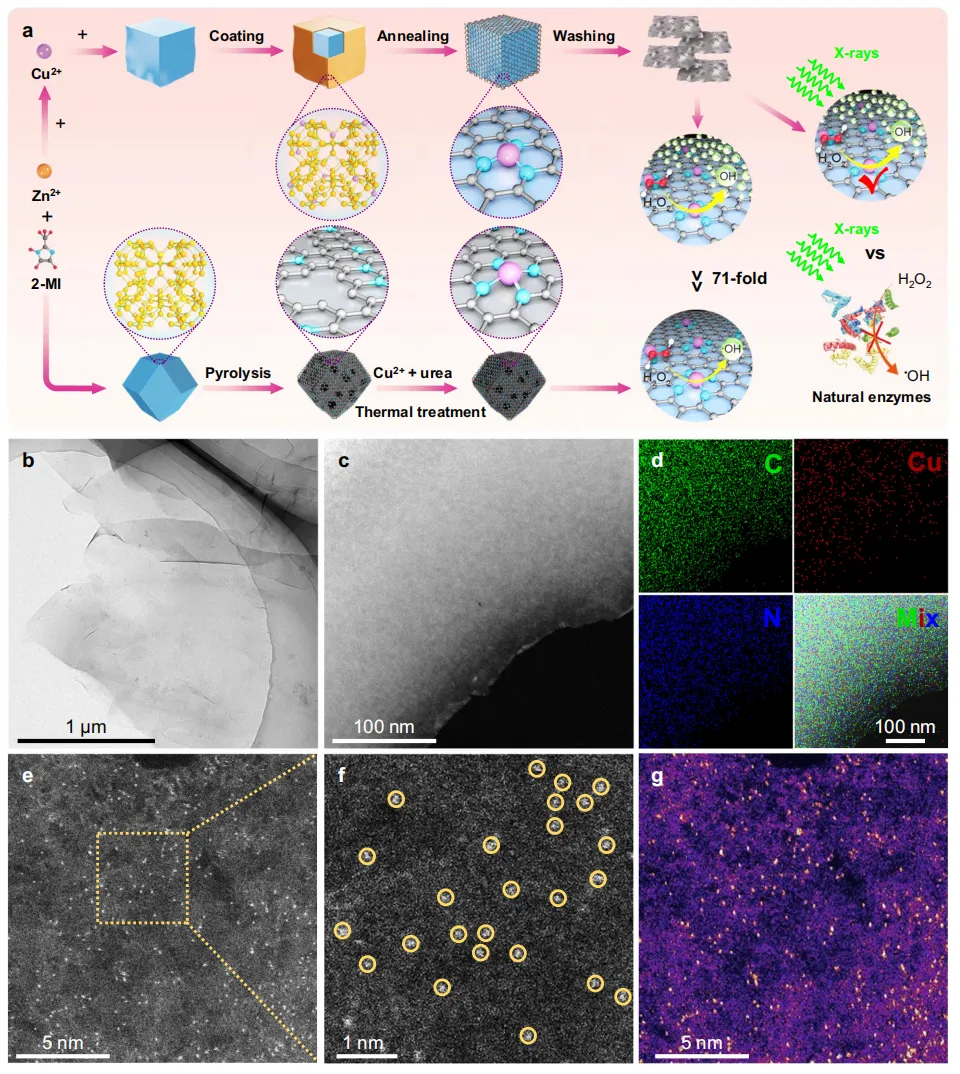
图1 CuN3-SAzyme的表征。
图1展示了CuN3-SAzyme和CuN4-SAzyme的合成过程及其结构表征,揭示了其物理化学特性。
图1a:示意图展示了CuN3-SAzyme和CuN4-SAzyme的合成过程,说明通过模板法和高温煅烧得到2D碳纳米片。图1b:透射电子显微镜(TEM)图像显示CuN3-SAzyme具有典型的2D特征和原子级光滑表面,验证其结构一致性。图1c:能量色散谱(EDS)图谱显示CuN3-SAzyme中C、N和Cu元素的均匀分布,确认其成分分布。图1d:能量色散谱(EDS)图谱显示CuN4-SAzyme中C、N和Cu元素的均匀分布,进一步验证其成分一致性。图1e:X射线衍射(XRD)图谱展示了CuN3-SAzyme的主要宽衍射峰,表明其为石墨碳结构且无明显Cu基纳米颗粒特征峰。图1f:X射线光电子能谱(XPS)分析显示CuN3-SAzyme中C和N元素的化学态,提供了具体的化学键信息。图1g:高角环形暗场扫描透射电子显微镜(AC HAADF-STEM)图像展示CuN3-SAzyme的原子级结构,确认了Cu位点的分布。
小结:图1全面展示了CuN3-SAzyme和CuN4-SAzyme的合成步骤及其结构特性,通过多种表征手段验证了其成分、结构和化学状态的一致性。
要点2:CuN3-SAzyme和CuN4-SAzyme的化学状态与配位环境
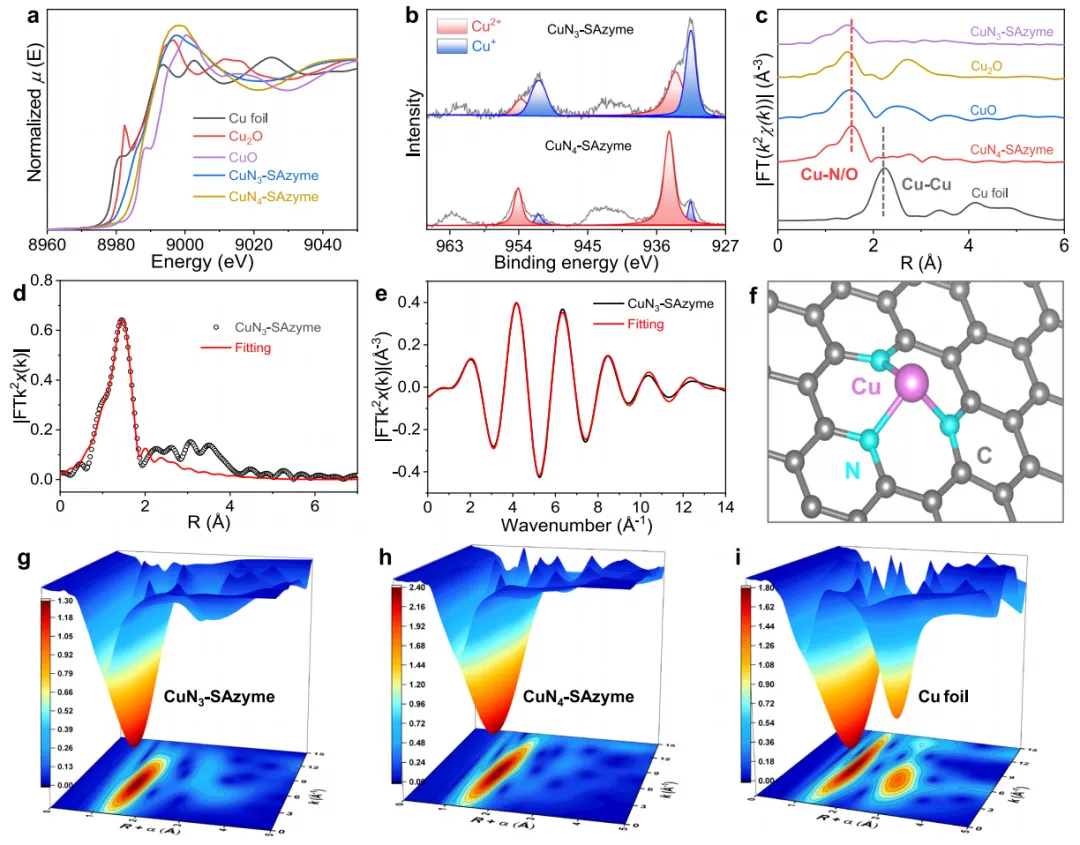
图2 CuN3-SAzyme的XAFS原子结构分析。
图2a:Cu K边X射线近边吸收结构(XANES)显示,CuN3-SAzyme和CuN4-SAzyme的吸收边介于CuOx纳米酶之间,表明CuN3-SAzyme的Cu物种化学价接近+1。图2b:Cu 2p X射线光电子能谱(XPS)显示,CuN3-SAzyme在931.4 eV处有一个峰,对应Cu+化学态,而CuN4-SAzyme在934.4 eV处有一个峰,对应Cu2+化学态。图2c:傅里叶变换的扩展X射线吸收精细结构(FT-EXAFS)光谱显示,CuN3-SAzyme和CuN4-SAzyme在1.5Å处有Cu-N主峰,未见2.3Å处的Cu-Cu配位峰,确认无金属Cu晶体结构。
图2d:R空间FT-EXAFS拟合图展示CuNx-SAzyme的配位环境,拟合结果验证了主要的Cu-N配位壳。图2e:k空间EXAFS拟合图展示CuNx-SAzymes的配位环境,拟合参数见补充表1,主要Cu-N配位壳见于~1.5Å。图2f:提出的CuN3活性基团结构模型显示Cu的三配位数。图2g:EXAFS小波变换(WT)分析图显示,CuN3-SAzyme的WT轮廓图在5Å-1处有单一强度峰,表明Cu与轻原子的配位。
图2h:CuN3-SAzyme的WT轮廓图不显示7Å-1处的强度峰,确认Cu物种无金属晶体结构。图2i:总结CuN3-SAzyme的单原子分散状态及其与CuOx 纳米酶和Cu箔的对比结果。
小结:图2通过XAFS光谱分析确认了CuN3-SAzyme和CuN4-SAzyme中Cu物种的配位环境及化学态,展示了其原子级结构及稳定性,证明其无金属晶体结构并具有优异的单原子分散特性。
要点3:CuNx-SAzyme的类过氧化物酶活性
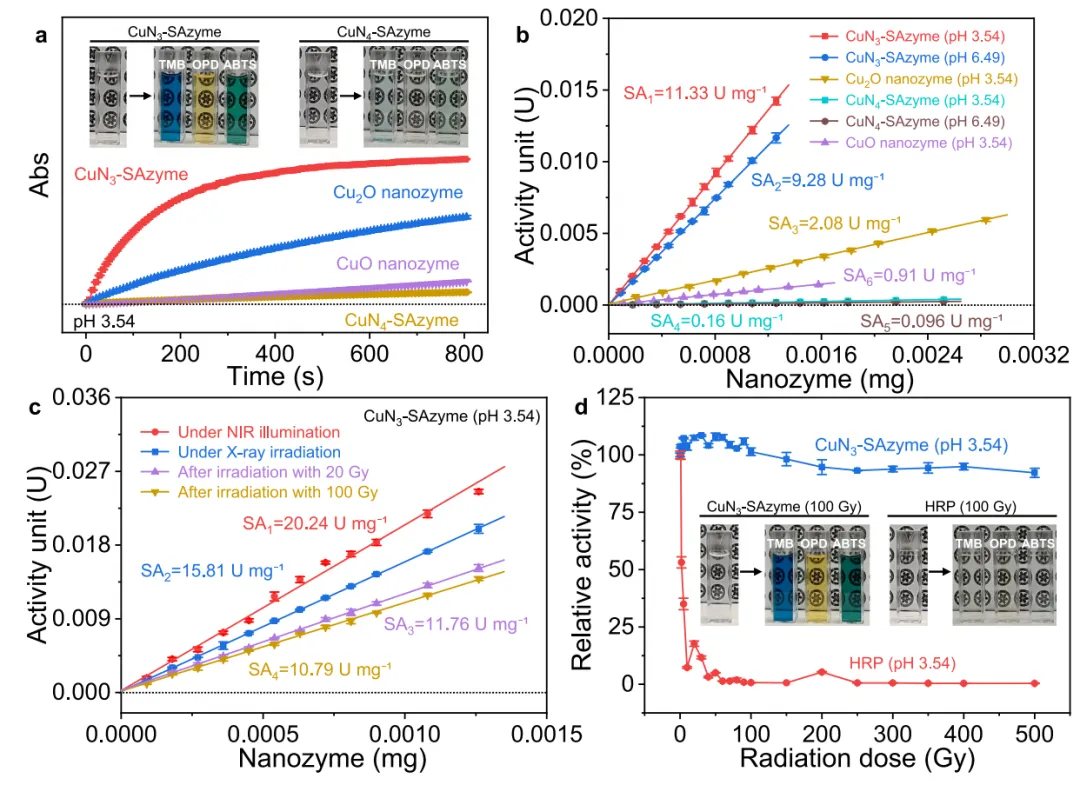
图3 酶活性的表征。
图3分析了CuN3-SAzyme和CuN4-SAzyme的类过氧化物酶活性,并比较了它们与天然辣根过氧化物酶(HRP)及其他Cu基纳米酶的性能。
图3a:显示CuN3-SAzyme和CuN4-SAzyme在H2O2存在下对TMB、OPD和ABTS等典型底物表现出类过氧化物酶活性,CuN3-SAzyme的TMB氧化产物吸光度显著高于其他纳米酶。图3b:计算的比活性显示CuN3-SAzyme(11.33 U mg-1)的酶活性显著高于CuN4-SAzyme(0.16 U mg-1)和Cux纳米酶,表明Cu位点的配位结构显著影响酶活性。
图3c:CuN3-SAzyme的催化活性遵循米氏动力学,显示其在pH=3.54条件下具有更高的催化效率(kcat/Km=6.56×103 M-1 min-1)和选择性(Km=1.61×10-3 M),远高于CuN4-SAzyme和CuOx纳米酶。图3d:H2O2底物的kcat和kcat/Vmax值也证实了CuN3-SAzyme在H2O2底物上的高酶活性,kcat=9.41 min-1,kcat/Km=1.43×102 M-1 min-1。
小结:图3通过实验结果和动力学分析,证明了CuN3-SAzyme比CuN4-SAzyme和CuOx纳米酶具有更高的类过氧化物酶活性,且其活性受Cu位点配位结构的显著影响。这为设计具有优异酶活性的单原子酶提供了重要依据。
要点4:CuN3-SAzyme 的酶活性与抗辐射性

图4 CuN3-SAzyme过氧化物酶样活性的DFT研究。
图4通过DFT计算和实验验证CuN3-SAzyme的酶活性与抗辐射性,展示其在H2O2分解中的优异性能。
图4a:DFT计算显示CuN3-SAzyme中的Cu原子d态能级分布更接近费米能级,说明其与H2O2分子有强相互作用,而CuN4-SAzyme中Cu原子的d态能级分布较远,H2O2不能有效吸附。图4b:计算的CuN3-SAzyme在pH=3.54和6.49下H2O2解离的能量曲线显示,O-O键的断裂和H2O的形成过程均易于发生,支持其高酶活性。图4c:DFT计算结果显示CuN3-SAzyme中Cu原子与N3基团的相互作用强度高达2.96 eV,确保Cu原子不易脱离,增强了其结构稳定性。图4d:AIMD模拟结果显示,CuN3-SAzyme在1773 K下的X射线辐射条件下,CuN3活性位点的几何结构稳定,验证了其抗辐射性。图4e:实验结果显示,CuN3-SAzyme在500 Gy高剂量辐射下类过氧化物酶活性略有下降,证明了其在高辐射剂量下的稳定性。图4f:进一步验证了CuN3-SAzyme对γ射线的抗辐射性,确认其酶活性和化学结构在γ射线辐射下无显著变化。
小结:图4通过DFT计算和实验结果,确认CuN3-SAzyme在H2O2分解中的高酶活性及其对X射线和γ射线的优异抗辐射性。这些发现表明,将CuN3活性基团锚定在2D碳纳米结构上显著提高了其抗辐射性能,为设计其他抗辐射单原子酶提供了新思路。
要点5:CuN3-SAzyme的放射酶疗与体内外抗肿瘤性能
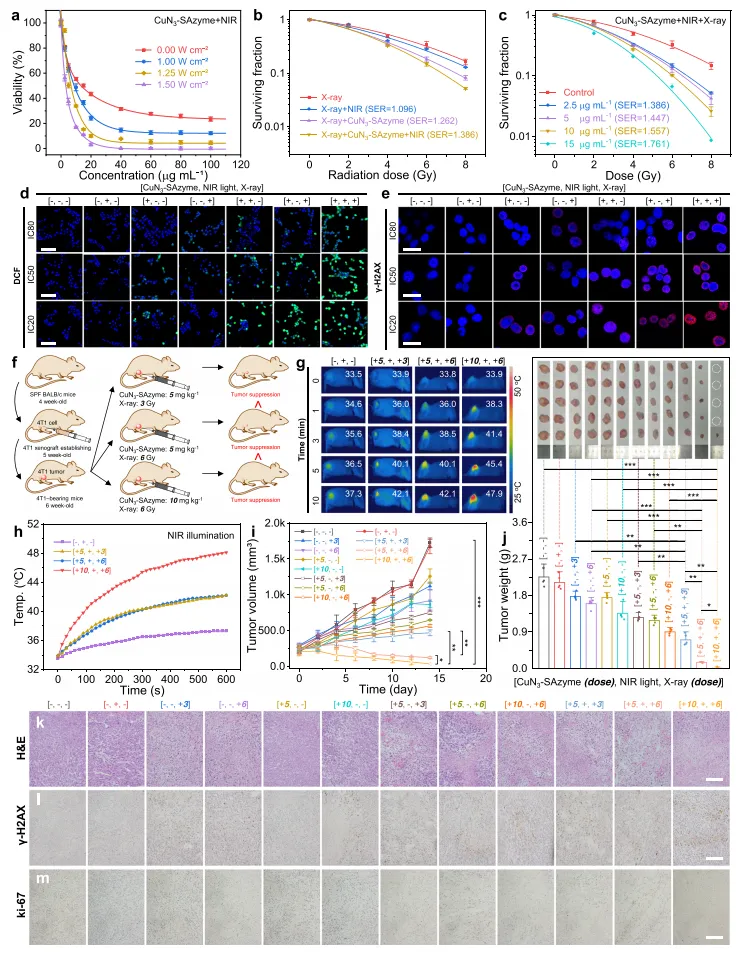
图5 体外和体内增强CuN3-SAzyme放射酶治疗。
图5评估了CuN3-SAzyme在放射酶疗中的应用效果及其体内外抗肿瘤性能,展示其在癌症治疗中的潜力。
图5a:CuN3-SAzyme通过超声处理减小至280 nm,zeta电位为-9.70 mV,能被细胞内吞,表现出对4T1和K7M2细胞的浓度依赖性毒性。图5b, c:CuN3-SAzyme与808 nm近红外光(NIR)和X射线联合照射,显著抑制细胞集落形成,抑制效率随浓度增加。图5d:CuN3-SAzyme在细胞水平催化生成更多的活性氧(ROS),有效杀死癌细胞。图5e:γ-H2AX荧光表明,CuN3-SAzyme在808 nm NIR光和/或X射线照射下导致4T1细胞的DNA双链断裂,ROS引发的细胞毒性显著增强。图5f:CuN3-SAzyme在小鼠体内注射后,随X射线照射显示出显著的光热效应,提升肿瘤部位温度。图5g, h:温度上升克服肿瘤缺氧微环境,增强肿瘤抑制效果。图5i, j:CuN3-SAzyme与X射线联合治疗在5和
10 mg kg-1剂量下显著抑制肿瘤生长。图5k, l, m:H&E和γ-H2AX染色病理图像以及Ki-67抗原表达最低,证实CuN3-SAzyme联合照射组的最佳抑制效果。
小结:图5表明CuN3-SAzyme在体内外对肿瘤具有显著的抑制效果,主要归因于其放射增强的类过氧化物酶活性和光热效应,同时在小鼠模型中表现出良好的安全性和生物相容性。这些结果证明了CuN3-SAzyme作为癌症治疗有效治疗剂的潜力。
全文小结
综上所述,研究者通过调控Cu-Nx配位结构,从理论上证明并实验制备了具有较高酶活性的CuN3-SAzyme,相较于CuN4-SAzyme,CuN3-SAzyme表现出更高的酶活性。外部场(包括808 nm近红外光和X射线)的引入显著增强了CuN3-SAzyme的酶活性和反应动力学。
此外,CuN3-SAzyme在重复的X射线照射和高剂量辐射后依然保持稳定,其酶活性没有显著下降,表现出优异的抗X射线辐射能力。因此,CuN3-SAzyme通过增强的放射酶疗方式可以完全消灭癌细胞,并显著减少对正常组织的损害。
这种简便而有价值的配位工程策略不仅为开发和优化具有优异酶活性和高抗辐射性的SAzymes提供了新见解,还可扩展应用于各种疾病的治疗,如通过增强的放射酶疗治疗肿瘤,从而在酶应用方面开辟新的前景和突破。
参考文献:Wu, J., Zhu, X., Li, Q. et al. Enhancing radiation-resistance and peroxidase-like activity of single-atom copper nanozyme via local coordination manipulation. Nat Commun 15, 6174 (2024).
https://doi.org/10.1038/s41467-024-50416-8
新闻稿出处:https://mp.weixin.qq.com/s/CXPWh5Xrvhgsm1lkC9C-4w