引 言[1-2]
本检测可以检测纳米银材料是否可以诱导淋巴细胞增殖或抑制由植物血球凝集素(phytohemaglutinin, PHA-M)诱导的淋巴细胞增殖响应。淋巴细胞可利用Ficoll-Paque分离液从混合的肝素抗凝的人全血中分离出来。这些细胞与纳米银材料混合培养后,通过比色分析法检测淋巴细胞增殖情况。
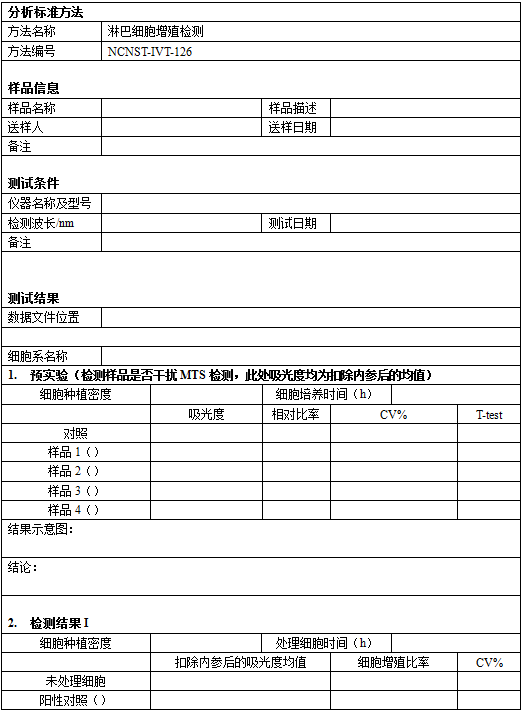
淋巴细胞增殖检测(MTS法)
Lymphocyte Proliferation Assay
1.原理
上述比色分析法,是将经过纳米银材料处理以及未处理的细胞与四唑化合物羧甲基苯基氢)和电子耦合剂吩嗪硫酸乙酯(具有增强的化学稳定性,这使它可与被细胞生物还原成为一种有色的甲臜(或小时后,检测特定光谱下(处检测到的甲臜产物的量与培养中的活细胞数成正比。淋巴细胞增殖检测也可按照国家标准[3]进行。
2.仪器与试剂
以下列出的产品供应商仅以提供产品信息为目的,可以由同类产品的其他供货商所替代。
2.1 试剂
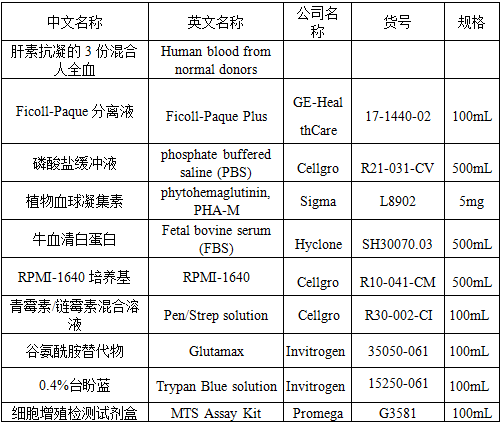
2.2 耗材
量程包括0.05至10mL的移液器、1.5mL微量离心管(EP管)、量程为0.5μL-1.0mL的枪头、平底96孔板
2.3 仪器
冰箱(4°C、-20°C、-80°C)、离心机、涡旋混匀仪、血球计数板、细胞培养箱、生物安全柜(生物超净工作台)、倒置显微镜
3.试剂配制
3.1 冻存液(无菌):由90% FBS和10%无菌DMSO配制而成,根据冻存细胞的数量现配先用,每支冻存管加1mL冻存液。
3.2 RPMI-1640完全培养基:10% FBS(经过热灭活)、2mM Glutamax、100U/mL青霉素、100μg/mL链霉素、500mL RPMI-1640或DMEM培养基。避光保存在2-8°C,不超过一个月。使用前,要37°C水浴中预热。
3.3 植物血球凝集素100μg/mL(储备液):先用5mL无菌1xDPBS溶解5mg PHA-M,再按照1:10的比例进一步稀释至100μg/mL,混匀后分装,-20ºC保存。避免反复冻融。
3.4 阳性对照(Positive control, PC):用RPMI-1640完全培养基作为稀释液,保证本实验PHA-M的工作浓度为2μg/mL。
3.5 阴性对照(Negative control, NC):用RPMI-1640作为阴性对照。
4.样品制备:纳米粒子溶液的配制
4.1 如果待测样品的最高工作终浓度为1mg/mL,那么按照1:5的稀释比例溶解于RPMI1640完全培养基中,依次稀释至终浓度(工作浓度)为0.2mg/mL、0.04mg/mL和0.008mg/mL。
4.2 在检测样品对淋巴细胞增殖的诱导能力时,由于样品与细胞悬液等体积加入,因此需提前配制2x浓度的样品溶液。每个浓度的样品溶液应该设置3个平行测定。
4.3 在检测样品对由PHA-M诱导的淋巴细胞增殖的影响时,需提前配制4x浓度的纳米银颗粒溶液。每个浓度的样品应该设置3个平行测定。
4.4 选择合适的纳米银材料浓度时,必须考虑以下几个问题:纳米银材料在某种生物相容性缓冲液中的溶解度、生理条件下的pH值(6-8)、纳米银材料的可用性及稳定性。如果1mg/mL的最高工作浓度不适合,需要对此浓度进行调整,一定要在适合的浓度下分析样品。
5.实验步骤
5.1 预实验(检测样品是否干扰MTS检测)
5.1.1 在培养细胞2天后,细胞密度达到80-90%。收集细胞,用台盼蓝进行细胞计数。如果活细胞比例达到90%以上,可以继续后面的实验。
5.1.2 用1 x PBS洗细胞一次,120 x g离心5min,弃掉上清。然后将细胞重悬至完全培养基中,终浓度为1x106 cells/mL。
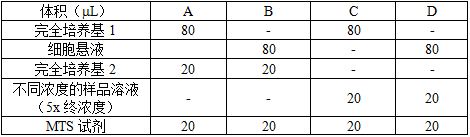
5.1.3 在96孔平底培养板中,按照表1。加入相应体积的的细胞悬液或完全培养基80mL。
5.1.4 在细胞培养箱中,37°C,5% CO2,培养24小时。
5.1.5 按表1,每孔分别加入20mL 完全培养基、“CellTiter 96® AQueous One Solution”试剂盒中的MTS溶液或样品组溶液(选择低、中、高3个浓度,5x终浓度)。(使用前,确保MTS溶液在室温放置至少1.5小时或在37°C水浴中10min至其完全解冻。)
5.1.6 放入细胞培养箱中,37°C,5% CO2,孵育2小时。立即在酶标仪中读取490nm的光吸收值(OD)。
5.1.7 比较B-A与D-C两个差值,根据T-test结果,判断样品是否会干扰MTS检测,在后续正式实验中,避免使用有影响的样品浓度。
表1 预实验每个实验组的加样设计方案
5.2 分离人淋巴细胞
5.2.1 在每个50mL离心管中分装15mL Ficoll-Paque溶液(如果使用15mL离心管,则每个离心管中加入3mL Ficoll-Paque溶液)。
5.2.2 使用1xPBS稀释全血,全血与1xPBS的比例为1:1。(如果是白膜细胞,按照1:2的比例稀释)。
5.2.3 在已装有Ficoll溶液的50mL离心管中,缓慢注入已稀释的全血,每个50mL离心管加35mL(每3mL Ficoll溶液加4mL全血稀释液)。
5.2.4 20°C离心,400xg,30min,升降的加速度均设置为1,不可中途停止。
5.2.5 离心后处于中层界面处的白色雾层为单个核细胞层(其中90%左右均为淋巴细胞)。先将最上层的血浆层移除,然后200mL的吸头将单个核细胞移至另一个离心管中(可吸取部分下层分离液,增加收率),并加入5倍体积以上的1xPBS洗细胞(或者使用3倍体积以上的培养基)。
5.2.6 室温离心,1500rpm,10min。
5.2.7 弃去上清,将细胞沉淀重悬于1xPBS(重复洗一遍),室温离心1500rpm,5min。
5.2.8 将所有细胞重悬于1xPBS中,并全部混合于一个离心管中。
5.2.9 使用台盼蓝和血细胞计数器计数,确认细胞存活率(应为90%以上)。
5.2.10 将实验细胞重悬于RPMI-1640完全培养基中,终浓度为-80°C或液氮中保存。
5.3 复苏冻存的PBMCs :取出冻存的单个核细胞,并将冻存管迅速置入37°C水浴中,完全解冻后,用70%消毒酒精擦拭冻存管外壁、将冻存管中的细胞悬液全部吸出放入装有8mL RPMI1640完全培养基的15mL离心管中,混匀、室温离心,1200rpm,5min。弃去上清。
5.4 在96孔平底培养板中,加入相应的样品或对照溶液:(如图1)
5.4.1 在检测样品对淋巴细胞增殖的诱导能力时:(1)对照组溶液100μL(其中阴性对照组加入2x PHA-M,使其终浓度为2μg/mL);(2)2x样品溶液100μL。
5.4.2 在检测样品对由PHA-M诱导的淋巴细胞增殖的影响时:(1)对照组溶液 100μL(其中阴性对照组加入RPMI-1640完全培养基,阳性对照组加入2x PHA-M,使其终浓度为2μg/mL);(2)4x样品溶液50μL + 4xPHA-M溶液50μL。
图1 96孔板加样示例(其中RPMI为阴性对照,PHA-M为阳性对照;样品1-3为不同终浓度的样品溶液)
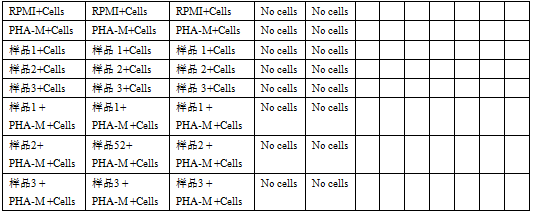
5.5 除无细胞的对照组外,其余每孔中加入100μL细胞悬液(细胞接种浓度为0.8×105个/孔),使每孔的终体积为200μL,轻轻摇动培养板使各组分混匀。对于无细胞的对照组(如B1-B2),则加入RPMI1640完全培养基100μL,设置2个平行孔。
5.6 在细胞培养箱中,37°C,5% CO2,培养3天。
5.7 每孔加入40μL “CellTiter 96® AQueous One Solution”试剂盒中的MTS溶液,放入细胞培养箱中,37°C,5% CO2,孵育4小时。(使用前,确保MTS溶液在室温放置至少1.5小时或在37°C水浴中10min至其完全解冻。)
5.8 先850rpm,室温轻轻混匀30s,在酶标仪中分别读取490nm和650nm(参考波长)的吸光度(OD)。
6.数据分析
6.1 变化系数百分比:CV%=SD/mean×100,其中SD为标准偏差,mean为平均值。
6.2 细胞增殖能力百分比=(样品OD490-650nm平均值-阴性对照OD490-650nm平均值)/阴性对照OD490-650nm平均值×100
6.3 增值抑制百分比=(阳性对照OD490-650nm平均值-样品/阳性对照OD490-650nm平均值)/阳性对照OD490-650nm平均值×100
7.接受标准
7.1 对于每个对照组以及检测的样品,CV%不能超过30%。
7.2 如果阴性对照都没能到上述接受标准,此检测需要重复。
7.3 检测实验是成功的,但如果对于某未知样品没能达到上述接受标准,这个未知样品需要重新被分析。
8.缩略语
MTS:3-(4,5-二甲基噻唑-2)-5-(3-羧甲基苯基)-2-(4-磺苯基)-2氢-四唑内盐
PES:吩嗪硫酸乙酯
PBS:磷酸缓冲盐溶液
EGF:表皮生长因子
FBS:胎牛血清
NC:阴性对照
PC:阳性对照
min:分钟
9.参考文献
[1] Current Protocols in Immunology. Edited by: John E. Coligan (NIAID, NIH);Barbara Bierer (Brigham & Women's Hospital); David H. Margulies (NIAID,NIH); Ethan M.Shevach (NIAID, NIH); Warren Strober (NIAID, NIH); Richard Coico (Weill Medical College of Cornell University); John Wiley & Sons, Inc.,2005.
[2] Standard practice for evaluation of immune responses in biocompatibility testing using ELISA tests, lymphocytes proliferation, and cell migration. ASTM F1906-98.
[3] SNT 2497.10-2010,进出口危险化学品安全试验方法 第10部分:T淋巴细胞增殖功能测定试验。
国家纳米科学中心分析报告