2019年9月6日,Science Advances(《科学-进展》)杂志在线发表了国家纳米科学中心陈春英课题组在抗肿瘤纳米药物研究领域的最新工作:可特异性杀伤乏氧肿瘤细胞的一种新型的短肽纳米纤维材料,及其在临床肿瘤治疗中的探索应用,论文题目为“New power of self-assembling carbonic anhydrase inhibitor: Short peptide–constructed nanofibers inspire hypoxic cancer therapy”(碳酸酐酶抑制剂小分子自组装化的新功能:短肽构建的纳米纤维启示的乏氧肿瘤治疗新策略)。首次报道了一种基于生物相容性较高的氨基酸短肽修饰普通碳酸酐酶抑制剂(CAI)的自组装纳米材料,靶向乏氧肿瘤细胞并实现特异性杀伤,为乏氧肿瘤治疗提供了新的机制和策略。
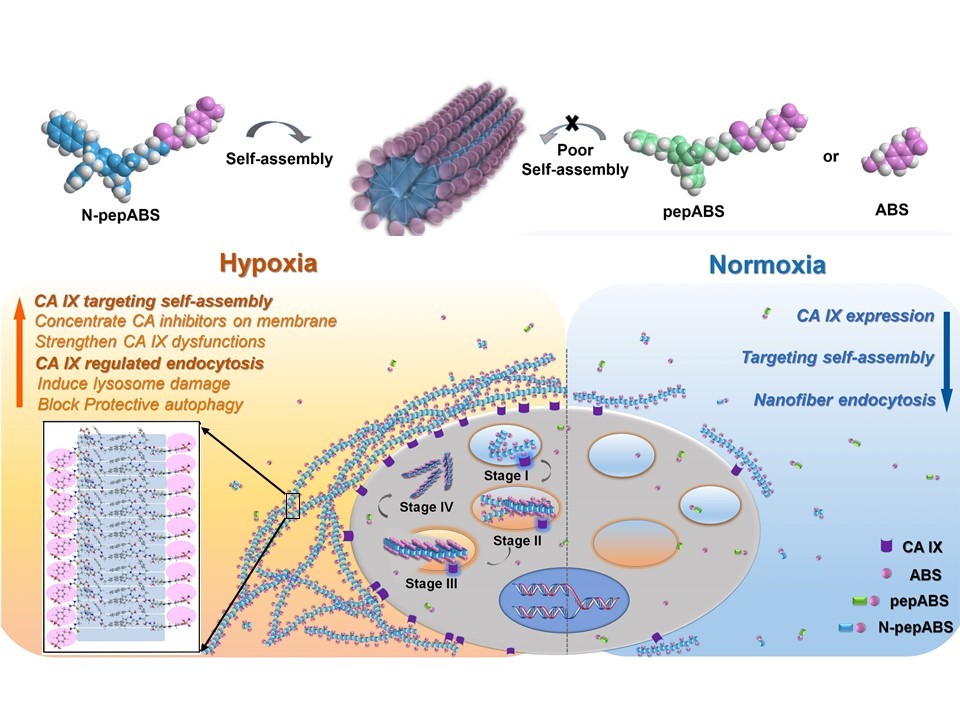
伴随着肿瘤的快速增殖,乏氧微环境对肿瘤生长和转移具有深远的临床意义,它们不仅显著增加了肿瘤部位内药物扩散的难度,而且还保护了肿瘤干细胞,并在传统的肿瘤放疗或化疗期间显著提高肿瘤细胞存活能力。作为乏氧诱导的跨膜酶,CA IX同工酶是乏氧肿瘤的特异性治疗诊断靶标。它们负责调节肿瘤组织中的酸性微环境以利于肿瘤细胞耐药及转移的发生,同时还将诱导肿瘤细胞在乏氧微环境中进行胞外物质摄取。因此,抑制CA IX同工酶作用已成为乏氧肿瘤治疗中抗肿瘤细胞增殖和转移,以及抗肿瘤组织血管生成等的重要手段。然而传统CAI对肿瘤相关CA IX缺乏足够的特异性抑制。利用纳米材料帮助CAI有效靶向肿瘤细胞膜上蛋白酶将成为CA IX靶向治疗的新策略。然而,目前纳米药物在乏氧肿瘤治疗中的应用受限于生物安全性、渗透性,以及材料稳定性等问题。如何简单、低毒、有效地增强CAI对CA IX酶的特异性靶向,如何借用纳米药物的优势提高CAI在乏氧肿瘤治疗中的效果与相关临床应用,依旧是人们关注的重点。
国家纳米科学中心陈春英课题组与其合作团队在高效低毒抗肿瘤纳米药物的研制及其作用机制的研究方面已获得一系列进展(Nano Letters, 2019, 19, 4692; Nature Communications, 2018, 9, 4861; Advanced Materials, 2017, 29, 1701268; Advanced Materials, 2016, 28, 8950; Nature Communications, 2015, 6, 5988)。近期的研究获得一种新型特异性杀伤乏氧肿瘤细胞的自组装短肽纳米纤维材料。研究人员利用生物安全性较高的短肽小分子修饰商用的CAI,实现靶向乏氧肿瘤细胞膜上CA IX同工酶的自组装,并对乏氧肿瘤细胞进行特异性杀伤。这种智能纳米药物具备生物安全性高,制备工序简单等优点,可以通过全新的治疗机制,实现更精确的药物递送,并推进现有化疗手段的临床应用。
作为生物医学应用的创新生物材料,短肽小分子自组装纳米材料已经在组织工程,免疫疗法,药物靶向递送,肿瘤细胞调控,以及肿瘤细胞内/细胞外成像等方面得到了广泛的应用。然而,目前为止短肽的自组装分子纳米材料仍缺少乏氧肿瘤治疗方面的探索。研究人员利用CA IX同工酶活性位点在乏氧肿瘤细胞膜外侧的特点,使短肽修饰的CAI小分子在细胞膜表面构建靶向CA IX的自组装。利用其更强的细胞膜外滞留时间以及结合CA IX的能力,这些自组装纳米纤维展现出对CA IX更强的抑制效力。同时,这种乏氧肿瘤细胞膜上的靶向自组装会进一步阻断乏氧肿瘤细胞的正常活动,其中包括干扰CA IX对肿瘤微环境pH的调控,并削弱乏氧肿瘤细胞转移迁徙的能力。更有意思的是,CA IX在乏氧微环境中介导的相关内吞作用将促进这些自组装纳米纤维进入乏氧肿瘤细胞内部,并在随后的内吞过程中,通过内吞囊泡中pH值的降低而改变着纳米纤维的形态和尺寸,从而导致乏氧肿瘤细胞内的酸性囊泡损伤以及保护性自噬阻断。这种乏氧肿瘤细胞微环境pH响应的结构可控自组装纳米材料为乏氧癌细胞提供了新的治疗机制和策略,有益于乳腺癌肿瘤治疗中的抑制肿瘤细胞增殖和转移,以及抑制肿瘤组织血管生成等,能显著提升现有临床化疗药物的治疗效果,为乏氧肿瘤治疗提供了一个全新方向。
国家纳米科学中心副研究员李佳阳、博士后史可鉴、博士研究生Zeinab Farhadi Sabet为该文章共同第一作者,陈春英研究员为通讯作者。该研究得到了国家重点研发计划,国家自然科学基金委和中科院国际合作等项目的支持。
原文链接:https://advances.sciencemag.org/content/5/9/eaax0937