



近日,国家纳米科学中心李乐乐研究员课题组与赵宇亮院士课题组合作,在DNA纳米医用器件的精准调控和肿瘤诊疗方面取得重要进展。研究成果“An Orthogonally Regulatable DNA Nanodevice for Spatiotemporally Controlled Biorecognition and Tumor Treatment”发表于Science Advances(2020, 6, eaba9381)。
生物识别是生命分析化学、疾病诊断和药物递送等领域的核心问题之一。例如,生物传感器是通过对特定分析物的识别以及可量化信号的输出实现生物检测和疾病诊断;对于生物成像和治疗应用,诊疗体系往往需通过特异性识别病灶部位特定受体以实现靶向性成像和药物递送,提高成像“信-噪”比并减少毒副作用。近年来,具有优良生物识别能力的功能性DNA分子被用于设计智能医用纳米器件,以期望在活体内完成特定高精度任务,如生物传感和成像、分子信息计算、可控药物运输。然而,这些纳米器件所识别的受体靶标并不是疾病组织所独有的,且在任务执行过程中不具备时间上的可控性,从而削弱了诊疗应用的特异性和精准性。目前,如何在时间和空间上调控纳米器件的生物识别功能以实现更加精准的生物应用仍然是一个挑战。
在前期工作中,李乐乐课题组首次提出了利用上转换发光远程操控生物传感以实现“时-空”可控生物检测的概念性方法(J. Am. Chem. Soc. 2018. 140, 578),并拓展实现了多种重要生物标志物的“时-空”可控精准检测和诊疗应用(J. Am. Chem. Soc. 2019, 141, 7056;Angew. Chem. Int. Ed. 2019, 58, 14877;Nat. Commun. 2019, 10, 2839)。在此基础上,该工作提出并验证了利用外源性上转换发光技术操控DNA纳米器件识别功能的新概念,以提高其对肿瘤细胞的靶向特异性;进而构建了正交近红外光驱动的DNA纳米器件,实现了“时-空”可控的肿瘤靶向和精准治疗。该DNA纳米器件是通过将设计的DNA适配体模块和光敏剂可控组装于上转换纳米颗粒表面而构建。该上转换纳米颗粒在两束不同波长的近红外光激发下产生正交的紫外光和可见光,分别用以激活适配体的生物识别活性和激发光敏剂产生活性氧,进而实现程序性的肿瘤精准靶向和光动力治疗。而且,该DNA纳米器件可与免疫检查点阻断疗法相结合,通过促进细胞毒性T细胞的肿瘤浸润,在荷瘤小鼠中引起协同效应和远端效应,实现对治疗无法企及的远端肿瘤的抑制。该工作为实现外源性工具控制DNA纳米器件在活体内的功能和行为迈出了重要的一步。
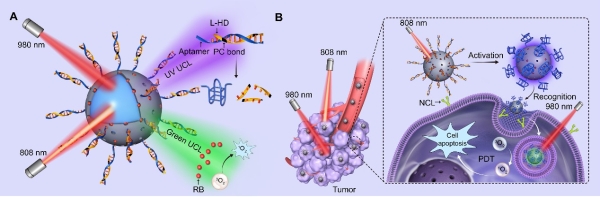
图:正交可调控的DNA纳米器件实现“时-空”可控的生物识别和肿瘤精准诊疗
国家纳米科学中心博士生狄正晗、刘蓓博士和赵健副研究员为该论文的共同第一作者;李乐乐研究员和赵宇亮院士为通讯作者。该研究得到国家自然科学基金委员会和国家高层次青年人才计划的大力支持。
文章链接:https://advances.sciencemag.org/content/6/25/eaba9381.full。