



近日,国家纳米科学中心李乐乐课题组报道了一种方法学以实现利用蛋白酶调控核酸功能,并以此为基础实现了两种肿瘤促转移标志物的空间选择性成像分析。研究成果先后以“Peptide Nucleic Acid (PNA)-Guided Peptide Engineering of an Aptamer Sensor for Protease-Triggered Molecular Imaging”和“A Multivariate-Gated DNA Nanodevice for Spatioselective Imaging of Pro-metastatic Targets in Extracellular Microenvironment”为标题发表于《德国应用化学》(Angew. Chem. Int. Ed. 2021, 60, 22659; Angew. Chem. Int. Ed. 2021, DOI: 10.1002/anie.202111836)。
蛋白酶是一类具有蛋白水解活性的酶,参与调节几乎所有的生理过程。蛋白酶活性的异常与多种病理有关。例如,许多蛋白酶在癌细胞中过表达,被认为是恶性肿瘤的重要生物标志物。在过去十年,大量蛋白酶响应型多肽探针和药物传递系统被开发用于生物成像和疾病治疗。然而,由于多肽与核酸迥异的分子结构和功能,目前缺少利用蛋白酶调控核酸功能的方法学,使得两个领域难以交叉。基于前期时空选择性分子成像的研究基础,研究人员巧妙设计了肽核酸-多肽-肽核酸三嵌段共聚物,通过引入肽核酸为“桥梁“实现功能核酸的多肽工程化,构建了具有蛋白酶触发特异性的核酸适体传感器,并应用于活细胞和活体内精准分子成像(图1)(Angew. Chem. Int. Ed. 2021, 60, 22659-22663)。该工作为构建核酸/多肽杂合体系提供了新方法,将通过促进核酸与多肽两个领域的交叉,为生物医学应用提供新方向。
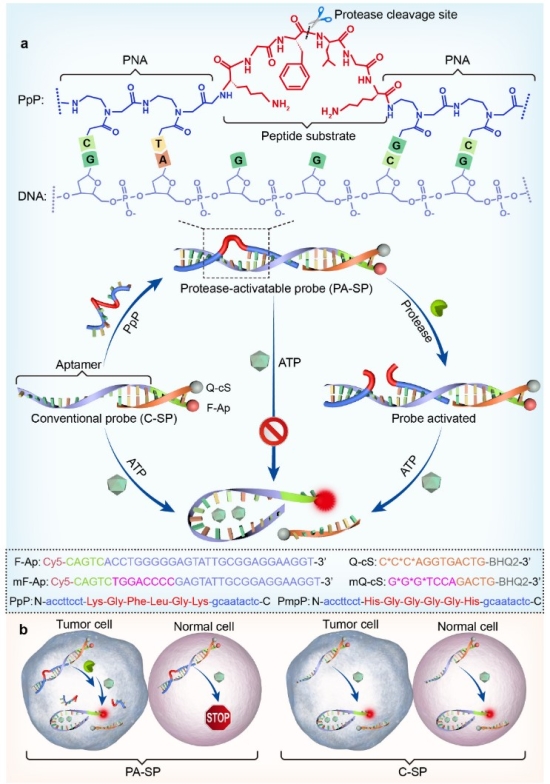
图1:肽核酸介导的功能核酸的多肽工程化
肿瘤转移是由包括肿瘤细胞内和细胞外微环境中的多种信号级联作用导致的,是癌症相关死亡的主要原因。其中,肿瘤细胞和免疫细胞释放到胞外的高浓度腺苷三磷酸(ATP)在塑造肿瘤微环境以及诱导基质金属蛋白酶(MMP2/9)相关肿瘤转移方面发挥着重要作用。原位检测这两类促转移靶标对于评估肿瘤转移的风险具有重要意义,但在细胞外微环境中对二者进行空间选择性成像极具挑战性。在上述核酸与多肽交叉桥联的基础上,研究人员通过设计肽核酸-多肽共聚物并结合核酸适体技术,构建了一种智能型DNA纳米器件,实现了对肿瘤细胞外微环境中这两种肿瘤促转移靶标的空间选择性成像(图2)(Angew. Chem. Int. Ed. 2021, DOI: 10.1002/anie.202111836)。该杂合型纳米器件的传感功能在无靶标或仅有一种靶标存在条件下处于关闭状态,只有MMP2/9和ATP同时存在条件下才会被开启,从而实现对肿瘤微环境中这两种分子进行关联性成像分析。该工作为解析这两种生物标志物在肿瘤转移中的病理作用以及评估肿瘤转移风险提供了新策略。
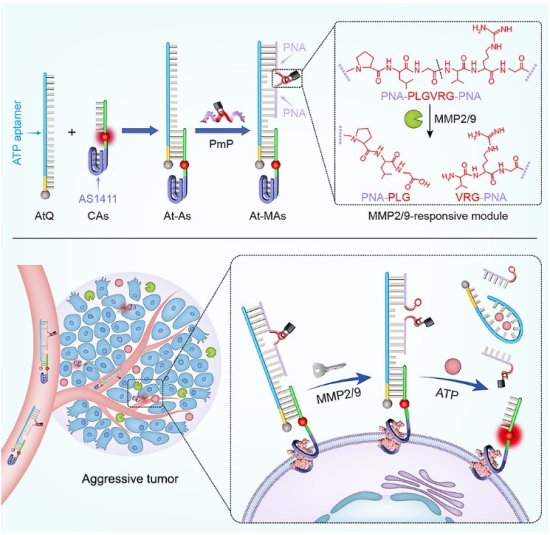
图2:DNA传感器件用于细胞外微环境中促转移双靶标的逻辑型成像
上述研究工作的第一作者均为国家纳米科学中心与深圳大学联合培养博士后向治楚,该工作得到了国家自然科学基金和北京市自然科学基金等项目的支持。