



免疫检查点阻断(immune checkpoint blockade,ICB)是肿瘤免疫治疗的主要手段之一。然而,临床数据显示,仅有部分患者对ICB治疗产生应答。由于肿瘤免疫抑制微环境在ICB治疗中起着至关重要的作用,如何有效重塑肿瘤免疫微环境并提高ICB治疗的应答率,成为当前研究的关键课题。
近日,国家纳米科学中心王海、聂广军研究团队联合重庆医科大学冉海涛教授团队,成功构建了一种金属离子螯合的L-苯丙氨酸纳米结构。这一创新设计能够有效重塑肿瘤免疫抑制微环境,显著提升ICB的免疫治疗效果。相关研究成果以Metal-ion-chelated phenylalanine nanostructures reverse immune dysfunction and sensitize breast tumour to immune checkpoint blockade为题,发表在《自然-纳米技术》(Nature Nanotechnology)期刊上。
树突状细胞(dendritic cells, DCs)在癌症和感染的先天免疫应答以及适应性免疫应答中发挥着至关重要的作用。成熟的树突状细胞是激活肿瘤特异性免疫的核心。然而,为了诱导DC细胞的成熟并触发初始免疫反应,在过去十年中研究人员发现了两种主要的激活模式:病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)。除了这些危险信号外,DC细胞的许多功能,包括成熟、细胞因子产生和迁移,也受到电生理反应的调控。DC细胞质中钾离子和钙离子的浓度与其成熟过程密切相关。然而,金属离子的出入受到离子通道的严格控制,而目前尚缺乏有效的调控手段来激活这些通道。
为了激活DC细胞膜上的钾离子通道,研究团队通过将镁离子、亚铁离子和锌离子分别与L-苯丙氨酸配位,制备了纳米球(Ph-Mg)、纳米针(Ph-Fe)和纳米片(Ph-Zn)三种纳米结构。进一步研究发现,这些纳米材料可以通过胞饮作用和小窝蛋白介导的内吞作用进入细胞内,但在酸性环境中均不稳定。计算模拟表明,解聚后的纳米结构会以金属离子螯合两个L-苯丙氨酸的二聚体形式释放。螯合的二聚体能够与钾离子通道(Kv1.3)的S4跨膜区域结合,导致Kv1.3整体结构发生相变,孔径扩大,通道加宽,从而激活钾离子通道。随着钾离子的外流,去极化诱导的钙离子流入激活了钙调素调节的NF-κB信号通路,促进DC细胞的成熟,并触发促炎细胞因子的分泌。此外,DC细胞摄取纳米结构可能会诱导组织蛋白酶B的释放,组织蛋白酶B与钾离子外排共同激活与DC细胞成熟密切相关的炎症小体途径。研究团队还发现,营养限制可以增强DC细胞对纳米材料的摄取,上调钙调素的表达和IkBα的降解,从而进一步增强NF-κB通路的活性。
本研究成功制备了能够调控离子通道结构的金属离子-氨基酸纳米结构,通过调节DC细胞内的钾离子和钙离子,促进先天免疫反应的激活,重塑肿瘤免疫抑制微环境,为提升ICB疗效提供了新的研究策略。
国家纳米科学中心联合培养的博士毕业生谭米肖和曹国梁为本文的共同第一作者,王海研究员、聂广军研究员和重庆医科大学冉海涛教授为共同通讯作者。该研究得到了国家自然科学基金、中国科学院战略性先导科技专项等项目的支持。
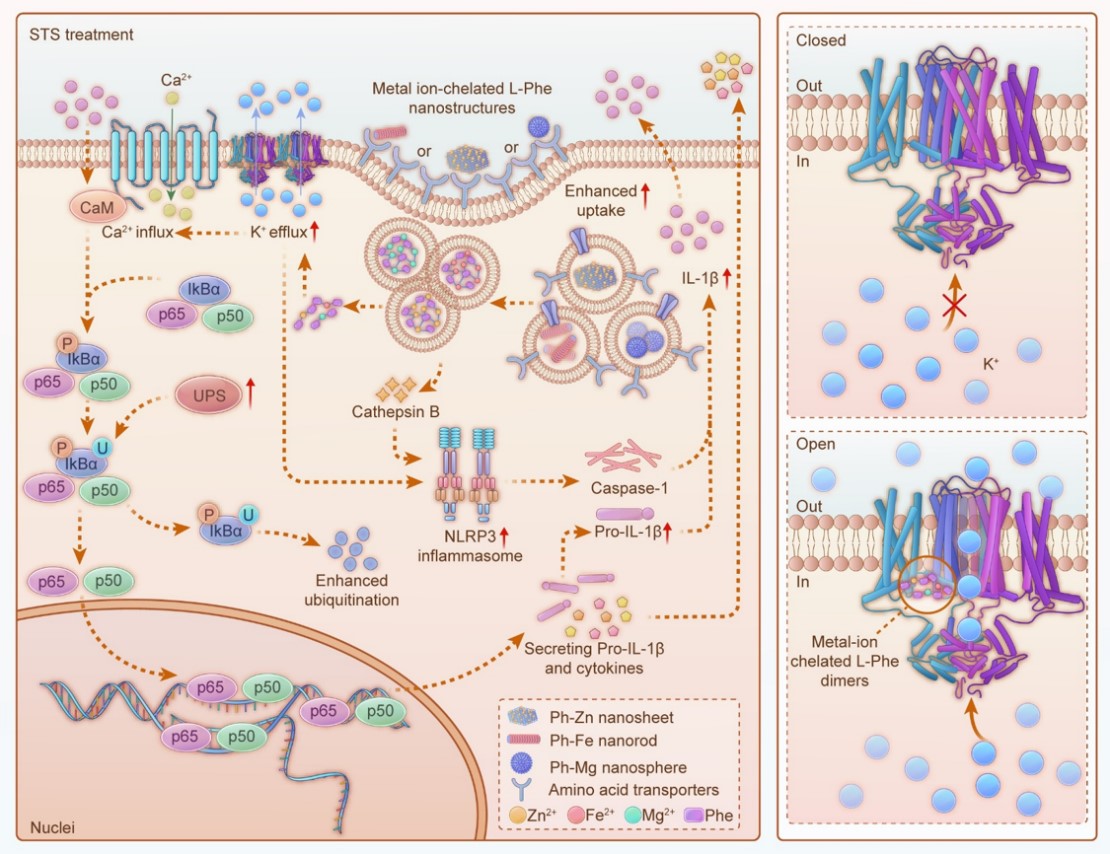
图. 金属离子螯合的L-苯丙氨酸纳米复合物介导的DC细胞疗法联合STS饮食增效肿瘤免疫治疗示意图
论文链接:https://www.nature.com/articles/s41565-024-01758-3