2023-11-06 恭喜李敏贤同学的文章在Nano Research发表
肺癌是世界上发病率和死亡率最高的癌症,其中非小细胞肺癌(NSCLC)约占所有肺癌的85%。Ⅲ期以上的患者无法手术切除,主要疗法是放疗以及基于铂类药物(如顺铂)的化疗。但由于顺铂在肿瘤部位的富集程度低,顺铂-DNA交联物的自身修复,抑制凋亡、促进迁移等相关通路被激活等原因,患者往往产生对顺铂的耐药性,治疗效果低于预期。
细胞核内组蛋白甲基转移酶EZH2在细胞凋亡、细胞周期调控、细胞分化等重要生物学过程中发挥重要的作用。近年来研究发现,EZH2高表达与肿瘤的发生发展及铂类耐药密切相关,因此,开发EZH2拮抗剂有望提高肿瘤细胞对铂类药物的敏感性,提高化疗药物的治疗效果。在团队的前期工作中,筛选得到一条与EZH2具有高亲和力和特异性的靶向拮抗多肽分子EIP103,该多肽分子能高效跨越细胞膜和核膜屏障,特异性结合EZH2蛋白,下调下游信号通路H3K27的二/三甲基化,抑制肺癌的增殖和发展进程[Int.J. Pharm ,2022 ,622 ,121894.],从而EIP103多肽药物的EZH2靶向能力使其逆转顺铂耐药成为可能。
将药物递送到耐药肿瘤深部具有很大挑战性。纳米载药系统能够同时负载多种类型药物分子,通过主/被动靶向效应能够将更多的药物分子递送至耐药肿瘤及其深部;与此同时,通过调整纳米载药系统的化学组成、尺寸、形状、表面化学修饰等还可以构建多种具有独特性能的纳米载体。因此,本文利用脂质体纳米载药系统联合细胞核EZH2靶向拮抗多肽分子EIP103,有望逆转非小细胞肺癌的顺铂耐药性,增强肺癌细胞对顺铂的药物敏感性,提高治疗效果,有望为改善肺癌铂类耐药患者的疗效提供新的思路和手段。
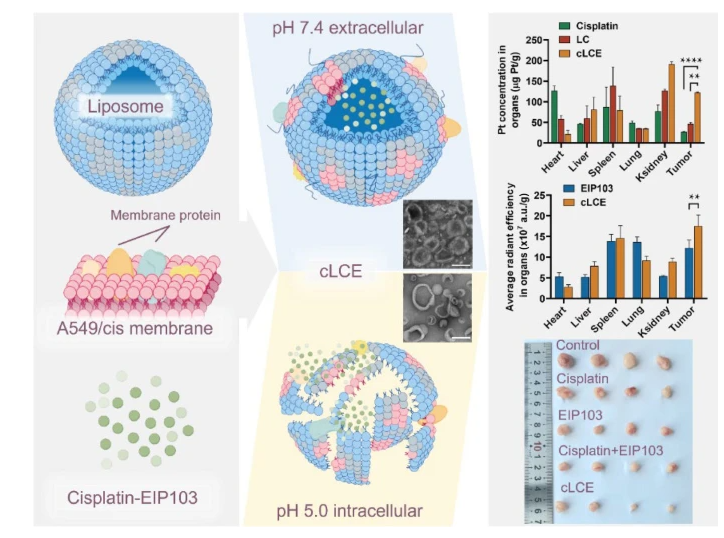
脂质体作为常用的纳米载药系统之一,多种脂质体纳米药物制剂已被用于临床。国家纳米科学中心研究人员开发了一种肺癌细胞膜杂合的酸响应释放纳米脂质体递送系统,同时包载多肽分子EIP103和化疗药物顺铂(A549/cis cell membrane hybridized liposomes containing cisplatin & EIP103,cLCE)。针对非小细胞肺癌的病理特点,对cLCE开展了体内外的生物学效应评价与分子机制研究。结果显示,在EZH2高表达非小细胞肺癌细胞中,cLCE能够有效逆转非小细胞肺癌的顺铂耐药,抑制肿瘤的增殖与转移。在非小细胞肺癌小鼠模型中,cLCE能够提高多肽分子EIP103和顺铂的稳定性以及在肿瘤部位的蓄积量,显著抑制肿瘤生长,延长荷瘤小鼠生存期。药效机制研究显示,cLCE通过下调N-钙黏蛋白和波形蛋白的表达,抑制顺铂耐药细胞A549/cis的迁移和侵袭;通过caspase 8途径促进肿瘤细胞的凋亡,通过下调神经生长因子受体(NGFR)的表达,促进过氧化物酶体激活受体(PPARγ)的表达等多种途径,实现对非小细胞肺癌顺铂耐药性的逆转。