2024-12-12 恭喜陈梦婷博士的文章在ChemBioChem发表
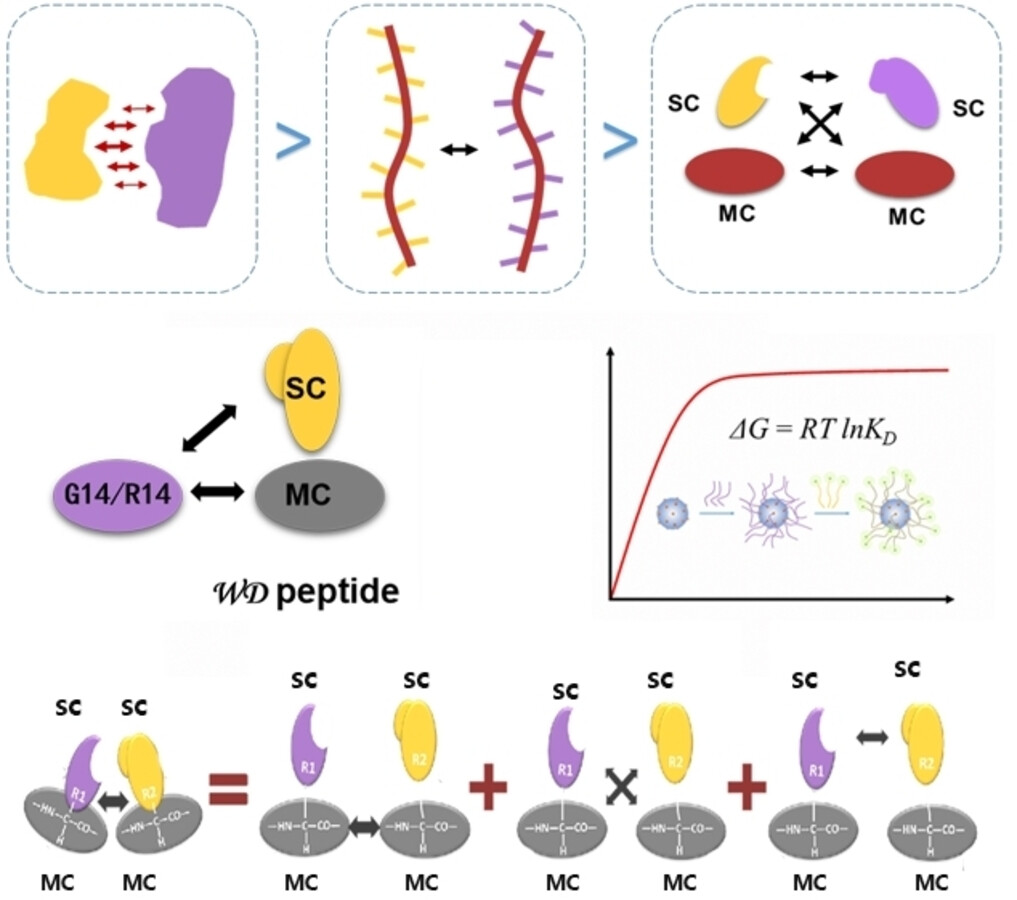
天冬氨酸扫描诱变揭示单个氨基酸的位置对静电相互作用的调控
我们在本文中通过分析涉及精氨酸-天冬氨酸、精氨酸-甘氨酸、精氨酸-色氨酸和色氨酸-甘氨酸的肽肽结合特性,考察了单个精氨酸和天冬氨酸之间的静电相互作用。天冬氨酸突变体的结果表明,精氨酸和天冬氨酸之间的相互作用显著依赖于氨基酸的位置和组成。然而,主要的相互作用可以归因于精氨酸-色氨酸之间的接触,这种接触源于吲哚部分与14肽主链之间的相互作用。其中包含 N-H 和 C=0 基团,通过与精氨酸和天冬氨酸之间的静电侧链-侧链相互作用,可以明显观察到增强效果。在相邻的天冬氨酸和色氨酸结合位点之间,将2到4个氨基酸进行最佳分离,可以实现相互作用增强的最大化。这种观察到的分离依赖性可以被用于揭示单个氨基酸对之间的非均质相互作用中的协同效应。
陈梦婷博士为第一作者,方小翠高级工程师、杨延莲研究员、王琛研究员为共同通讯作者。
原文地址:https://chemistry-europe.onlinelibrary.wiley.com/doi/full/10.1002/cbic.202400891