近日,国家纳米科学中心蒋兴宇研究员、郑文富研究员、雷祎凤博士和中国人民解放军总医院301医院肝胆外科姜凯教授、日本东北大学医学院Yoh Hamada教授等合作,在微流控芯片上构建神经-肿瘤研究模型,以金纳米簇为神经生长因子小干扰RNA (NGF siRNA)载体,在靶向胰腺的神经微环境、治疗胰腺肿瘤的研究中取得重要进展。相关研究成果“Gold nanoclusters-assisted delivery of NGF siRNA for effective treatment of pancreatic cancer”被《自然通讯》(Nature Communications)杂志于2017年4月25日在线发表。
最新研究表明,神经微环境对于肿瘤(尤其是胰腺肿瘤)的发生、发展和转移中起到重要作用。研究肿瘤与神经微环境的相互作用、信号传导和分子机制,将为肿瘤的诊疗提供新的诊断依据和药物靶点。
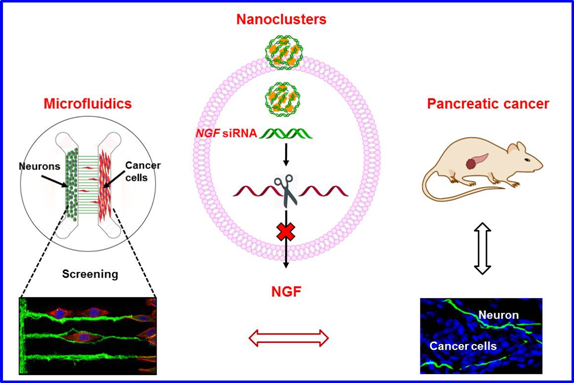
蒋兴宇研究组一直致力于利用微流控芯片进行体外神经研究模型构建、神经发育、神经系统疾病机理等方面的研究 (Electrophoresis, 31, 3144, 2011;Small, 8, 676, 2012;Integr Biol, 5, 617, 2013; Integr Biol, 5, 1244, 2013; Small, 10, 2530, 2014)。同时在肿瘤的纳米药物靶向治疗方面也有重要进展(Angew Chem Int Ed, 54, 3952, 2015; Adv Mater, 27, 1402, 2015; ACS Nano, 9, 9912, 2015; Biomaterials, 104, 269, 2016; Small, 13, 1603109, 2017)。在近期工作中,蒋兴宇研究组关注到神经微环境在肿瘤发生、发展中的作用,首先开发了一种高通量的微流控芯片,用以体外研究神经-肿瘤细胞相互作用,并通过微流控芯片进行高通量快速药物筛选(Integr Biol, 8, 359, 2016)。基于体外微流控芯片的筛选结果,该研究组设计了一种靶向神经递质受体的纳米药物,通过调控肿瘤的神经微环境从而抑制胰腺肿瘤的生长、发展和转移(J Control Release, 232, 131, 2016)。
前期的研究表明,靶向神经递质受体是可以有效抑制肿瘤的,但仍不是一种理想的安全有效的调控肿瘤微环境的方法。最近,该研究组将胰腺癌(号称“癌症之王”,5年生存率<5%)作为研究对象,将小干扰RNA(siRNA)靶向胰腺癌肿瘤组织高表达的神经生长因子(NGF)作为治疗手段,开发了一种基于金纳米簇(直径小于3nm)的NGF siRNA的递送平台,通过NGF基因的沉默来调控胰腺肿瘤的神经微环境和肿瘤发展。相对于传统药物载体材料而言,该金纳米簇由于其独特的超小尺寸效应和表面正电荷,具有常规材料前所未有的高载药量,可以为siRNA提供有效保护,延长siRNA在体内的循环时间,提高siRNA在肿瘤部位的靶向聚集。 通过皮下肿瘤、原位肿瘤以及病人来源(PDX)三种胰腺癌小鼠模型的活体成像、组织切片分析等实验验证,证明金纳米簇携带的siNGF可以有效沉默胰腺癌组织中的NGF基因,从而有效抑制胰腺癌的发生和发展,为胰腺癌的诊疗开辟了一种全新的手段。该研究还将促进纳米微流控芯片在药物筛选、芯片上的器官、临床检测等方面的应用。
该研究得到了国家自然基金委、中科院“创新团队国际合作伙伴计划”等项目的支持。
论文链接:https://www.nature.com/articles/ncomms15130