



国家纳米科学中心聂广军课题组联合北京大学高宁课题组,利用天然蛋白质复合物,研发出一种具有肿瘤靶向作用及肿瘤微环境响应性的天然蛋白质纳米机器,实现在ATP的驱动下可控释放疏水性抗肿瘤药物。相关研究成果“Chaperonin-GroEL as a Smart Hydrophobic Drug Delivery and Tumor Targeting Molecular Machine for Tumor Therapy”发表于2018年2月的《Nano Letters》上。
该研究利用细菌体内的天然蛋白质—分子伴侣GroEL作为可携带疏水药物的纳米机器,应用于肿瘤治疗。分子伴侣通常在蛋白质合成过程中介导多肽分子正确装配。GroEL具有的双层笼状结构能够为底物多肽分子提供一个疏水环境,并在多肽分子完成折叠后由ATP激发改变构象。蛋白构象的变化导致其内部由疏水微环境变成亲水性环境,进而主动释放底物,完成一个循环。本研究中,基于天然蛋白质结构和功能特点,利用GroEL装载疏水药物多柔比星,通过响应肿瘤微环境中的高浓度ATP,实现肿瘤特异性的触发释放药物,杀伤肿瘤细胞。该纳米机器实现了药物的时空间精准可控释放。该研究还意外地发现GroEL能够与异常高表达于肿瘤细胞膜表面的plectin分子特异性结合,赋予GroEL一定程度的肿瘤靶向性。研究结果表明,GroEL可携带疏水药物多柔比星富集于小鼠皮下胰腺癌组织中,释放药物并有效抑制肿瘤的生长。该研究基于生物系统的天然蛋白质结构和功能,发展了具有精确制导、定点药物释放作用的纳米机器,为恶性肿瘤等疾病的治疗提供了新思路和无限潜能。
国家纳米科学中心的袁嫕、杜冲和孙翠骥为本工作的共同第一作者。该研究得到国家自然科学基金委、科技部、中科院和北京市科委的项目支持。
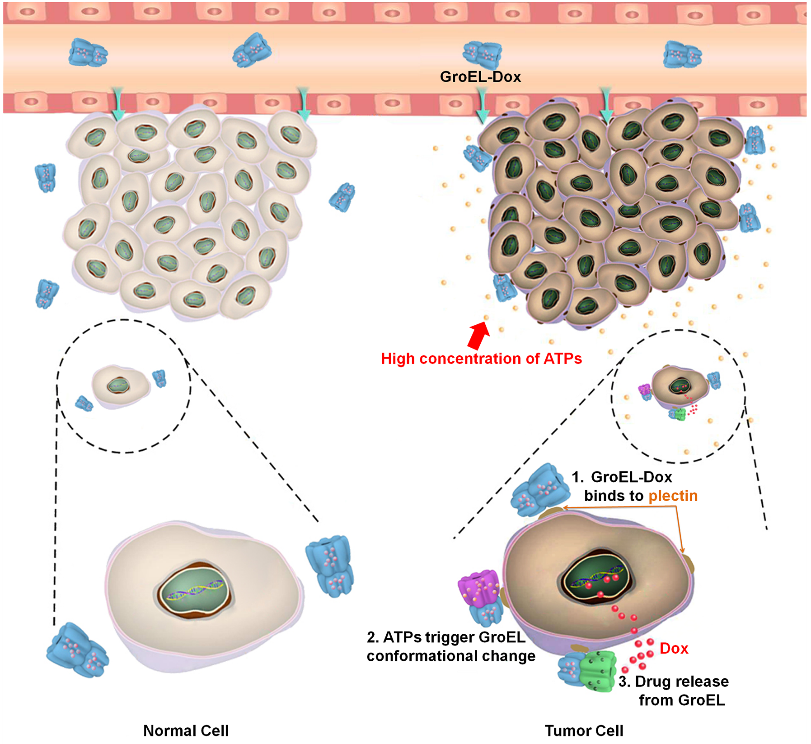
图:GroEL运载多柔比星(Dox),靶向肿瘤细胞,并由ATP激发释放药物的示意图