



近日,国家纳米科学中心陈春英研究员团队与合作者在纳米颗粒表面软蛋白冠原位动态分析方面取得重要进展,相关研究成果以In situ Analysis of Nanoparticle Soft Corona and Dynamic Evolution为题,发表于Nature Communications,DOI: 10.1038/s41467-022-33044-y。
在纳米颗粒与生物体作用过程中,生物微环境的蛋白质将通过与纳米颗粒表面作用及蛋白质-蛋白质作用,形成多层“纳米蛋白冠”。在纳米颗粒表面,具有高亲和力和慢解离速率的蛋白会形成“硬蛋白冠”,而具有低亲和力和快解离速率的蛋白则形成“软蛋白冠”。多层蛋白冠尤其是外层软蛋白冠直接参与调控纳米颗粒跨屏障过程、体内生物识别、输运与代谢及生物学效应,因此多层蛋白冠的结构与成分分析非常关键。
离心分离法常用于研究硬蛋白冠组分,该方法需经过反复高速离心和连续洗脱,难以获得表面的软蛋白冠。目前,仍然缺乏分析软蛋白冠结构和组分的普适方法,制约了软蛋白冠及其生物效应研究。如何动态地表征蛋白冠的形成与演化过程以及如何原位表征多层蛋白冠和软蛋白冠的组成和结构,一直是纳米生物医学研究面临的重大方法学挑战之一。
在前期工作的基础上,研究团队应用生物膜干涉技术与生物质谱等技术,建立了纳米颗粒表面多层蛋白冠的原位、动态分析方法。该方法可实时监测蛋白冠的形成、交换和解离过程,通过原位、快速地洗脱多层蛋白冠的组分,实现了软、硬蛋白冠的高效分离、鉴定及时间分辨的动态研究,突破了软蛋白冠分析的技术瓶颈。基于此方法,发现纳米颗粒表面配体手性影响软、硬蛋白冠的组分进而产生不同的血液清除速率,即D-型比L-型纳米颗粒的软蛋白冠富集更多的调理素蛋白,导致D-型纳米颗粒血液循环时间更短、网状内皮系统清除更快。该原位分析方法还适用于超小、低密度纳米颗粒及软物质的表面蛋白冠研究。本研究提出的多层蛋白冠的分析新策略将为探究纳米颗粒与生物体相互作用,以及纳米药物的理性设计提供创新分析方法。
中国科学院大学Baimanov Didar博士后、北京大学天然药物及仿生药物国家重点实验室副主任技师王静为该论文共同第一作者,国家纳米科学中心陈春英研究员、中国科学院高能物理研究所王黎明副研究员、中国科学院大学温州研究院周云龙研究员为通讯作者。上述工作得到了国家重点研发计划、中国科学院战略性先导专项、国家自然科学基金、北京同步辐射装置建制化科研平台等项目资助。
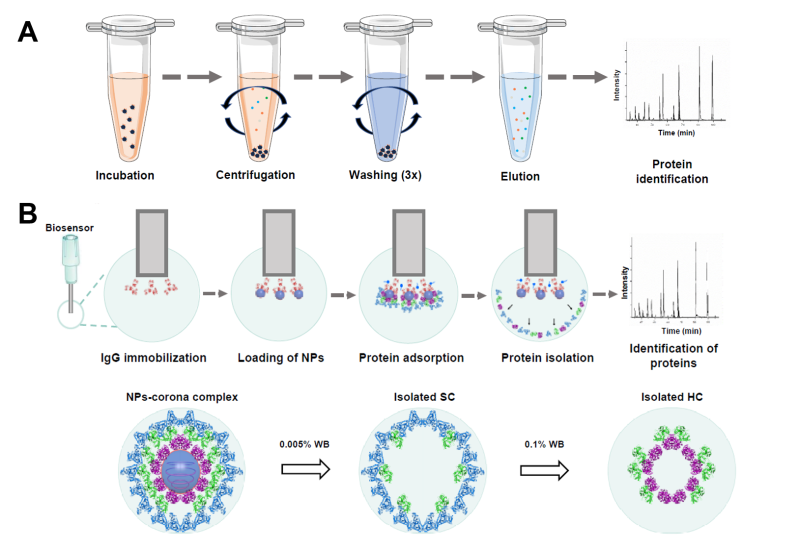
图. 纳米颗粒表面多层蛋白冠原位分析方法与传统分析方法的区别。(A)传统离心法,(B)本研究开发的多层蛋白冠原位、动态分析方法。