



近日,国家纳米科学中心丁宝全研究员课题组在利用DNA纳米机器递送基因编辑系统进行靶向基因治疗方面取得重要进展。研究成果以A DNA Origami-Based Gene Editing System for Efficient Gene Therapy in Vivo为题,发表在Angew. Chem. Int. Ed.杂志上(DOI: 10.1021/anie. 202315093)。
基因编辑作为一类定点的核酸操控技术,已被广泛应用于分子生物学研究中,并有望发展成为一类高效的基因治疗药物。然而,如何获得有效且安全的基因编辑递送系统是关键。DNA作为遗传信息的载体,可基于碱基互补配对,经自组装形成具有特定尺寸和形貌的纳米结构。DNA纳米结构具有优异的结构可设计性和生物相容性,在可控装载和智能递送核酸和蛋白等生物大分子方面具有显著优势。近年来,丁宝全课题组在利用核酸纳米载体递送基因治疗药物领域已获得了一系列进展(J. Am. Chem. Soc. 2023, 145, 9343; J. Am. Chem. Soc. 2022, 144, 6575; Angew. Chem. Int. Ed. 2021, 60, 1853; J. Am. Chem. Soc. 2019, 141, 19032; Angew. Chem. Int. Ed. 2018, 57, 15486)。由此而发展的基于核酸化学修饰与可控自组装的药物递送系统有望为疾病的诊断和治疗提供新思路。
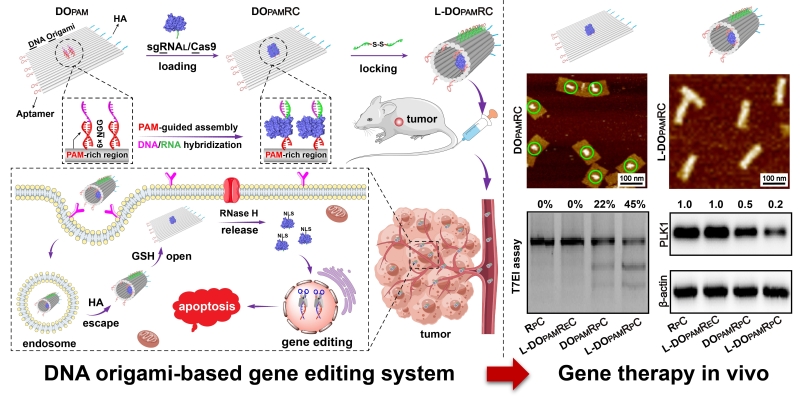
图. 利用DNA纳米机器递送基因编辑系统实现活体水平的精准基因治疗
在前期研究的基础上,该团队提出利用DNA纳米机器递送基因编辑系统的概念。首先,将靶向性核酸适配体(aptamer),内涵体逃逸肽(HA)和富含PAM位点的核酸序列精确定位组装到同一个DNA折纸结构上。随后,末端延伸的sgRNA和Cas9蛋白相结合所形成的基因编辑复合物,能够被高效地招募和组装到核酸纳米载体上。最后,在含有二硫键的核酸分子锁的作用下,成功组装得到基于DNA纳米机器的基因编辑递送系统。在核酸适配体的精确引导下,该类DNA纳米机器能够靶向识别并被内化进入肿瘤细胞,进而在内涵体逃逸肽和谷胱甘肽的作用下得以顺利开启核酸结构,最后经RNase H酶的辅助下高效释放基因编辑复合物。小鼠活体实验结果表明,该类基于DNA纳米机器的基因编辑递送系统表现出非常好的肿瘤靶向性和生物相容性,能够对活体肿瘤产生显著的基因编辑和治疗效果。该研究基于核酸自组装机制,充分利用组装结构对生物环境内标志分子的响应性,实现了对基因编辑系统的智能递送,为恶性肿瘤等疾病的治疗提供了新的研究策略。
国家纳米科学中心与郑州大学联合培养的博士生唐挽涛为本文的第一作者。国家纳米科学中心丁宝全研究员和刘建兵副研究员为共同通讯作者。该研究得到了国家重点研发计划、国家自然科学基金、北京市科技新星计划和中国科学院青年创新促进会等项目的支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202315093