



除有效性外,如何诱导持久的免疫反应仍然是当代疫苗开发的一大挑战。常用的铝佐剂刺激TH2免疫和激活体液免疫反应,但在刺激TH1和 CD8+T细胞免疫方面受到限制。尽管铝佐剂被广泛使用,但其作用机制目前仍没有统一明确的结论。因此,研发具有长效保护作用的新佐剂疫苗具有重要意义。
与传统佐剂相比,纳米佐剂具有更多的优势,可以提升抗原的稳定性,实现精准设计调控尺寸、形状和表面性质,来增加淋巴结靶向和抗原递呈细胞(APCs)的摄取,提供抗原主动运输策略,更有效地激活机体的天然免疫和适应性免疫。近年来,国家纳米科学中心陈春英院士团队在疫苗佐剂的精准构筑方面开展了一系列研究(Nano Lett. 2012, 12, 2003-2012; Adv. Mater. 2013, 25, 5928-5936; Nano Today, 2021, 38, 101139; Nano Today, 2022, 42, 101353; Natl. Sci. Rev., 2023, nwad161; Nano Research, 2023, 10.1007/s12274-023-6295-5),开发了基于碳材料、多肽水凝胶、纳米铝、纳米锰等佐剂,针对亚单位疫苗、核酸疫苗的抗原特异性,优化配方进行了深入的免疫学评价。
近日,陈春英院士团队在Signal Transduction and Targeted Therapy发表题目为Durable and enhanced immunity against SARS-CoV-2 elicited by manganese nanoadjuvant formulated subunit vaccine的研究论文。该论文评价了纳米锰佐剂新冠亚单位疫苗的免疫持久力及其相关的机制。
在前期工作的基础上,研究人员评价了纳米锰佐剂与新冠病毒受体结合域蛋白(RBD)同源二聚体配伍的亚单位疫苗的免疫持久力,其抗原特异性抗体(IgG)水平维持至少360天。在第360天,锰佐剂疫苗的真病毒中和水平仍是传统铝佐剂的3倍。与铝佐剂相比,纳米锰佐剂尤其促进了B细胞对抗原的摄入,促进生发中心的形成以及生发中心B细胞的比例。为了进一步探索免疫记忆现象的背后的生物学机制,研究人员通过质谱流式(CyTOF)技术对免疫锰佐剂后的小鼠肌肉标本和淋巴结标本进行分析。结果发现,锰佐剂免疫后,在肌肉部位迅速招募包括DC、B细胞在内的免疫细胞,促进主要组织兼容性复合体II(MHC II)分子的表达从而促进抗原递呈。在淋巴结内,锰佐剂激活记忆淋巴细胞,包括记忆T细胞、辅助T细胞,并促进B细胞的成熟。
因此,纳米锰佐剂通过靶向淋巴结,促进抗原递呈细胞对抗原的摄入,从而促进抗原呈递。进一步,纳米锰佐剂激活淋巴结内B细胞,促进记忆细胞及生发中心的产生,从而诱导长期免疫记忆,为免疫持久疫苗的研发提供了新思路。
国家纳米科学中心特别研究助理郭梦雨、曹明晶及广东省疾病预防控制中心孙九峰教授为该论文的共同第一作者,王亚玲研究员,陈春英院士为该论文共同通讯作者,中国科学院微生物学研究所高福院士和戴连攀研究员在新冠RBD二聚体疫苗方面给予了支持和帮助。本研究工作得到国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项 (B类)、中国医学科学院创新工程等项目的资助。
论文链接:https://www.nature.com/articles/s41392-023-01718-8#Sec1
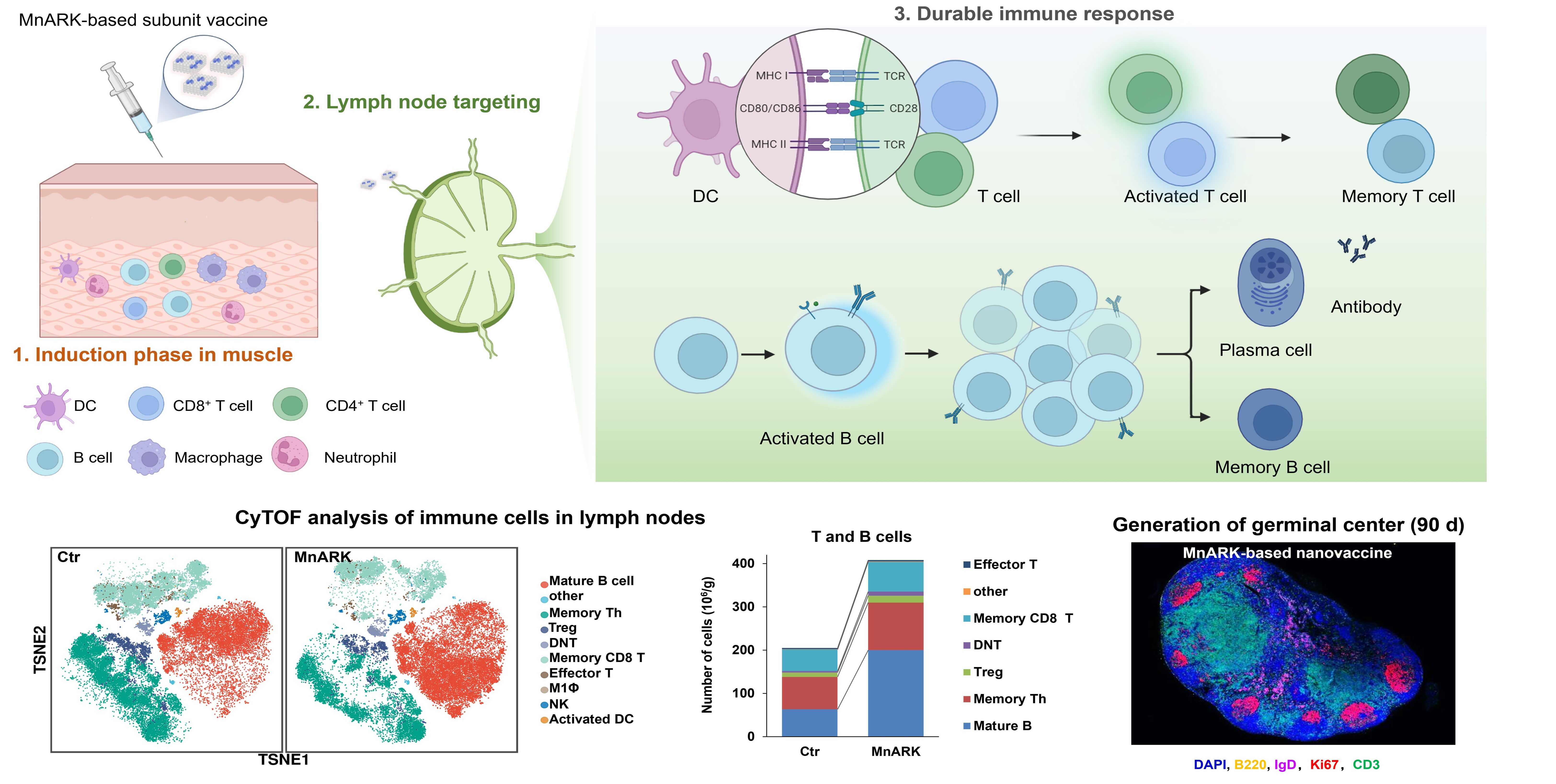
图1 基于纳米锰佐剂的亚单位疫苗诱导免疫记忆及长时间免疫应答。