



mRNA肿瘤疫苗安全性好、有效性高、研发周期短,在癌症免疫治疗领域内具有巨大的应用潜力。mRNA疫苗在抗原呈递细胞(APCs)中高效表达与呈递,以实现有效的免疫刺激,对肿瘤特异性免疫增效至关重要。当前,尽管已有多种递送系统用于增强mRNA的细胞摄取、促进溶酶体逃逸等关键过程,但仍只有1-2% 的mRNA被有效释放到细胞质中,且胞质游离mRNA半衰期短,严重限制了抗原蛋白的表达。因此,仍然需要从mRNA递送的不同过程着手,提升mRNA的胞质翻译表达效率。
国家纳米科学中心陈春英院士团队长期致力于开发基于纳米载体的核酸递送,旨在将其应用于免疫治疗等领域,已在质粒、miRNA与siRNA递送的相关工作,从多个维度有效增强了核酸细胞内功能(Adv Mater,2020,2006189; ACS Nano,2020,14,15700; Adv Mater,2021,2100556; ACS Nano,2024,18,19232)。近日,该团队在Science Advances发表题目为 mRNA Compartmentalization via Muti-Module DNA Nanostructure Assembly Augmentsthe lmmunogenicity and Efficacy of Cancer mRNA Vaccine的研究论文,独辟蹊径地提出了mRNA区室结构有效促进mRNA表达效率,显著提高mRNA疫苗免疫原性,提升抗肿瘤免疫反应。
该研究利用DNA杂交链式组装技术,构建了基于多功能模块DNA纳米结构的mRNA肿瘤疫苗,实现了对mRNA抗原模块、CpG佐剂模块、酸响应模块和树突状细胞(DC)靶向模块的精准整合。该纳米疫苗被DC细胞高效摄取,利用酸响应DNA序列在溶酶体酸性环境下形成较大组装体,显著增强CpG佐剂效应。组装体逃逸溶酶体后,在胞质内构建mRNA的区室结构,允许翻译相关分子进入区室高效执行mRNA翻译功能,从而有效提升抗原蛋白的表达和呈递效率。动物实验显示,该纳米疫苗能有效诱导特异性细胞免疫,抑制肿瘤生长及转移,并激发长期记忆T细胞免疫保护。该研究创新性地在细胞内构建区室,优化mRNA表达微环境,增强抗原表达及特异性呈递,为开发高效mRNA纳米疫苗和提升肿瘤疫苗免疫效果提供了新策略。
国家纳米科学中心特别研究助理郭小翠、郭梦雨为该论文的共同第一作者,蔡绒研究员、刘晶研究员、陈春英院士为共同通讯作者。该研究工作得到新基石研究员项目、基础科学中心项目、国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项 (B类)、中国医学科学院创新工程、北京市自然科学基金等项目的资助。
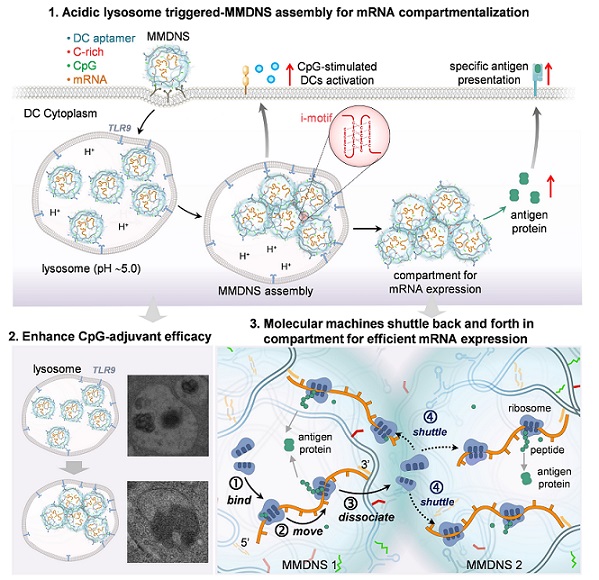
图1 多模块DNA纳米结构胞内组装构建mRNA区室增强mRNA肿瘤疫苗免疫效力
论文链接:https://www.science.org/doi/10.1126/sciadv.adp3680