



近日,国家纳米科学中心赵瑞芳、聂广军团队与北京大学口腔医院韩冰团队合作,在开发通用型肿瘤预防性纳米疫苗研究中取得新进展。相关研究成果以Potent prophylactic cancer vaccines harnessing surface antigens shared by tumour cells and induced pluripotent stem cells为题在线发表于《自然-生物医学工程》(Nature Biomedical Engineering, 2024,DOI: 10.1038/s41551-024-01309-0)。
到2030年,全球每年新增恶性肿瘤病例将高达2200万,庞大的恶性肿瘤患者群体将会给社会带来巨大的压力。为了减轻癌症负担,肿瘤预防性疫苗的研究热火朝天。近年来,HPV和HBV疫苗成功降低了病毒感染相关的宫颈癌和肝癌的发病率。 然而,大部分的恶性肿瘤为非感染引起的。不同于病毒相关性肿瘤预防疫苗开发有明确的病毒衣壳蛋白作为疫苗抗原,非感染类恶性肿瘤细胞基因组特征非常多样,没有明确的通用型肿瘤抗原(肿瘤共享抗原)被报道过。
为了实现广泛的肿瘤预防,研究团队巧妙的从肿瘤细胞生理的角度出发捕捉肿瘤共性特征来寻找共享抗原。例如,正常细胞变成肿瘤细胞时,会获得某些特定的功能,比如持续增殖,这些增殖的特征和诱导多能干细胞类似。研究团队假设,细胞转化为可持续增殖的细胞(肿瘤细胞或诱导多能干细胞)时,包括持续增殖等共性特征相关的基因驱动细胞膜上表达一类特征蛋白质,这个特质蛋白组可以作为反应肿瘤特征的共享抗原库。为了验证这个假说,研究团队首先制备了基于多能干细胞膜的预防性肿瘤纳米疫苗,证明了该纳米疫苗能够显著激活B细胞和T细胞免疫反应,并在多种临床前癌症预防模型中展现出显著的抗肿瘤免疫保护作用。在此基础上,项目研究团队开发了一种鉴定细胞膜上肿瘤共享抗原的方法,鉴定出了膜上与免疫原性相关的肿瘤共享抗原肽,这些抗原具备广谱的肿瘤预防能力,并可以在健康人外周血单核细胞中诱导显著的抗原特异性免疫反应。此外,研究团队还证明了这些肿瘤共享抗原具有良好的安全性,不会引起自体免疫安全风险。
这种利用细胞无限增殖能力的共享表型进行肿瘤共享抗原开发的策略,绕过了鉴定单一抗原或抗原组合的繁琐过程,提升了抗原鉴定效率,为广谱肿瘤预防性疫苗研发提供了新的思路。
国家纳米科学中心博士生李楠、副研究员覃好、博士后朱飞为该文章的共同第一作者。赵瑞芳副研究员、聂广军研究员和韩冰教授为文章的共同通讯作者。上述研究工作得到了国家自然科学基金基础科学中心,中国科学院战略性先导科技专项和北京市自然科学基金等项目支持。
聂广军团队长期致力于基于细胞膜纳米技术增强抗肿瘤免疫的系列研究。通过肿瘤细胞膜与细菌内膜的共同递送,制备成个性化的杂合膜纳米肿瘤疫苗(Science Translational Medicine 2021;Nature Protocols 2022);利用细菌外面膜泡作为肿瘤疫苗载体和免疫调节剂,发展了多肽抗原递送(Nature Communications 2021)和训练免疫增效的肿瘤疫苗(Nature Nanotechnology 2024);利用细菌生物矿化产生肿瘤免疫调节剂用于肿瘤辅助治疗(Nature Communications 2023)等。
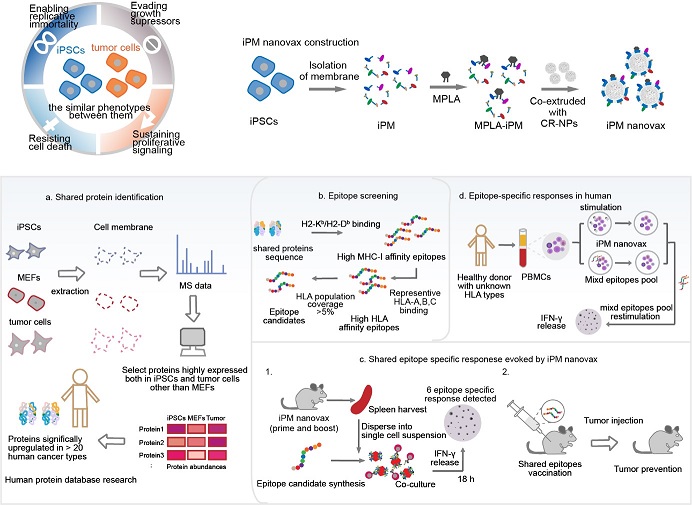
图:肿瘤预防性疫苗设计原理、制备流程和作用机制
原文链接: https://www.nature.com/articles/s41551-024-01309-0