



近日,国家纳米科学中心陈春英院士团队与苏州大学李瑞宾教授团队合作,在纳米毒理学领域取得重大研究进展。相关成果以Intracellular Dehydrogenation Catalysis Leads to Reductive Stress and Immunosuppression为题,发表于Nature Nanotechnology (DOI: 10.1038/s41565-025-01870-y)。
氧化还原 (Redox)平衡是维持细胞正常代谢与功能的关键因素。传统毒理学研究多聚焦于细胞内氧化性物质 (如 •OH,O₂⁻•,ROO•,¹O₂ 等)累积如何引发“氧化应激”,导致亚细胞器损伤、DNA 断裂及炎症等毒性效应。然而,对于细胞内还原性分子(例如, NAD(P)H、GSH等)累积所导致的“还原应激”与生物危害,长期以来缺乏系统性研究。近年来,科学界逐步认识到 “还原应激” (Reductive Stress)可能与心血管疾病、神经退行性疾病及肿瘤转移密切相关。然而,还原应激的具体触发机制与信号通路有待深入解析。
研究团队通过纳米材料库的高通量筛选,发现金属硼化物纳米材料能够模拟脱氢酶活性,加速细胞内关键的脱氢代谢反应,导致 NAD(P)H 和 GSH 等还原性分子的累积,从而引发细胞还原应激 (图1)。这一独特的生物效应可进一步诱导免疫抑制细胞因子的释放,促进免疫抑制细胞的分化,加剧肿瘤的转移。该研究首次揭示了纳米材料脱氢催化引发还原应激,进一步导致免疫抑制与肿瘤转移的分子机制,解析了 “类脱氢酶催化—还原应激—免疫抑制—肿瘤转移” 这一新的生物学信号通路。这一发现突破了传统毒理学研究以氧化应激为核心的范式,为化学物质及新材料的生物安全性评估提供了新的理论框架,也为免疫调控、肿瘤转移机制研究开辟了新方向。
陈春英院士和李瑞宾教授为共同通讯作者,高兴发研究员团队进行了理论模拟。上述研究工作获得了国家重点研发计划、新基石科学基金、国家自然科学基金等项目的资助。
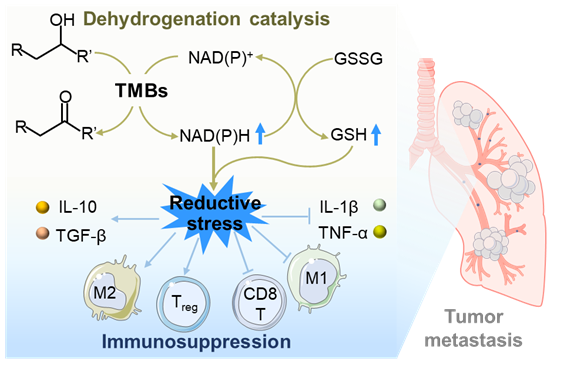
图1 纳米材料脱氢催化引发还原应激、免疫抑制和肿瘤转移
全文链接:https://www.nature.com/articles/s41565-025-01870-y