



近日,国家纳米科学中心梁兴杰研究团队报道了一种基于仿生物理屏障(Biomimetic Physical Barrier,BPB)的肿瘤免疫治疗新策略,为增强实体瘤免疫疗效提供了全新解决路径。相关成果以“Controlling T cell-tumor cell interaction with a biomimetic physical barrier for cancer immunotherapy”为题,发表在《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America,PNAS)。
近年来,肿瘤免疫治疗取得显著进展,然而T细胞在肿瘤微环境中的迅速耗竭限制了其功效。T细胞是人体免疫系统中发挥核心杀伤功能的免疫细胞,能够识别并清除肿瘤细胞,是抗肿瘤免疫响应过程中的主要执行者。在未经干预的条件下,多数T细胞因持续暴露于肿瘤细胞的抑制性相互作用而演变为终末耗竭T细胞,致使其杀伤活性和增殖能力大幅下降。研究团队受基质纤维化屏障的启发,设计了一种以温敏水凝胶为核心的仿生物理屏障,可通过近红外光触发凝胶-溶胶相变,从而实现T细胞与肿瘤细胞相互作用的时序调控,增强浸润T细胞的蓄积,延缓T细胞耗竭。
研究发现,该物理屏障经瘤内注射后可在肿瘤组织内建立T细胞“保护区”,暂时阻断T细胞与肿瘤细胞的相互作用,避免T细胞过早耗竭的同时促进抗肿瘤活性更强的“耗竭前体T细胞”蓄积。当T细胞在肿瘤组织中蓄积到理想水平后(屏障形成6天后),给予近红外光照射触发水凝胶相变以移除物理屏障效应,使得T细胞能够以更有利的状态、更强的杀伤能力和更高的数量攻击肿瘤细胞,从而发挥抗肿瘤效果。
该策略在小鼠4T1乳腺癌模型、CT26结肠癌模型、原位肝癌模型和MDA-MB-231人乳腺癌人源化免疫系统小鼠模型中均表现出对肿瘤生长的显著抑制作用。进一步研究表明,BPB策略与OX40激动抗体的联合治疗可诱导更强的系统性抗肿瘤免疫反应,表现为对未处理对侧肿瘤的抑制,对记忆T细胞比例的提升以及对肿瘤再挑战的长期保护。该研究基于物理性干预提出“免疫节奏控制”新策略,以动态调控T细胞耗竭进程,为肿瘤免疫治疗开辟了新路径。
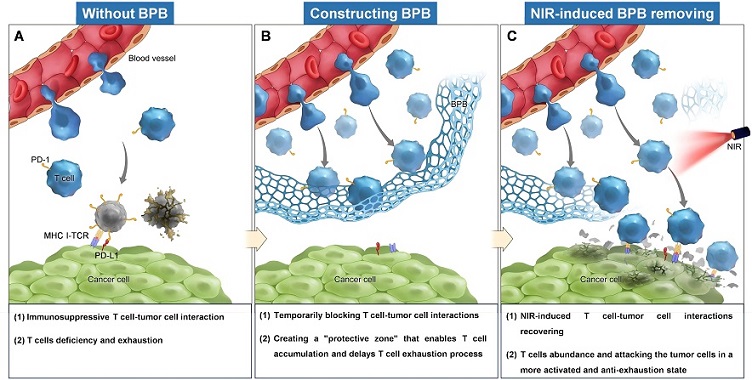
图1. 基于仿生物理屏障的肿瘤免疫治疗新策略
国家纳米科学中心张宇轩博士、王琎琎博士、卿光超博士为本文的共同第一作者,国家纳米科学中心梁兴杰研究员、中国科学技术大学宫宁强教授为本文共同通讯作者。上述研究工作得到国家重点研发计划、国家自然科学基金等项目的支持。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2500589122