



近日,国家纳米科学中心梁兴杰研究团队在Science Advances上报道了一种基于牛奶来源纳米囊泡(milk-derived nanovesicles,MiNVs)的口服胰岛素递送新策略。该研究为解决口服胰岛素开发过程中肠道和肝脏屏障的难题提供了一种新的思路,为糖尿病治疗开辟了潜在的应用前景。相关成果以“Site-specific adaptive nanovesicles for oral insulin delivery”为题发表于《科学进展》(Science Advances)。
糖尿病是一种慢性代谢性疾病,全球患病人数8亿多人。1型糖尿病及部分晚期2型糖尿病患者需长期依赖外源性胰岛素以维持血糖稳态。然而,临床应用的胰岛素主要通过皮下注射给药,这一侵入性方式患者依从性较差,且增加了低血糖和代谢副作用风险。相比之下,口服途径更接近内源性胰岛素的分泌模式,是一种理想的给药方式,但胰岛素在胃肠道降解、肠上皮屏障通透性不足以及肝脏清除等方面均面临严峻挑战。
在本研究中,团队提出利用MiNVs可跨越胃肠道屏障的特性来解决上述问题。MiNVs来源于牛奶外泌体,具备天然的生物安全性和规模化制备优势。研究发现,MiNVs表面可结合天然免疫球蛋白G(IgG),并通过新生儿Fc受体(FcRn)介导的跨上皮转运成功穿越肠上皮屏障,从而吸收入血,经肝门静脉到达肝脏,然后在肝脏微环境中响应释放,从而有效避免了早期肝脏清除。
本研究构建了糖尿病猪模型、大鼠模型和小鼠模型,实验表明,MiNVs可以将胰岛素的口服生物利用度提升至20.4%,约为游离胰岛素的20倍。我们在糖尿病猪模型中发现,长期口服治疗不仅可实现稳定的血糖控制,还可以有效控制糖尿病动物的体重保持平稳。更为重要的是,MiNVs可通过模拟胰岛素的生理分泌节律,实现了跨肠道—肝脏屏障的精准递送,具有非常好的生物安全性(无脏器毒性和免疫原性)。
该研究提出 “跨肠道—肝脏双屏障适应性递送”的策略,展示了外泌体类材料在口服给药中的潜在价值,并为糖尿病等慢性病的长期治疗提供了新思路。
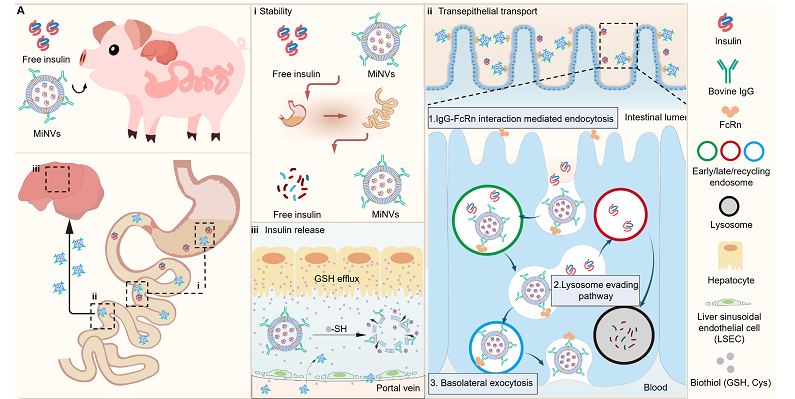
图1. 牛奶来源纳米囊泡实现胰岛素的高效口服递送
国家纳米科学中心夏伯彰博士、博士生徐冯斐、北京航空航天大学陈军歌副教授为本文的共同第一作者,国家纳米科学中心梁兴杰研究员、北京航空航天大学陈军歌副教授、浙江大学王金强教授和意大利罗马第二大学Massimo Bottini教授为本文共同通讯作者。上述研究工作得到国家重点研发计划,国家自然科学基金重点项目等项目的支持。
原文链接:https://doi.org/10.1126/sciadv.ady6386