



近期,国家纳米科学中心赵潇/聂广军团队与北京生物技术研究所王恒樑团队合作在开发理性设计和精确组装的传染病纳米疫苗方面取得新进展,相关成果以Rationally designed multimeric nanovaccines using icosahedral DNA origami for display of SARS-CoV-2 receptor binding domain为题,发表在Nature Communications上。该研究基于DNA纳米技术构建了形状和大小与SARS-CoV-2非常相似的定制纳米疫苗,理性设计并构建了具有不同表面抗原图案参数(包括抗原间距、抗原簇数以及簇内抗原拷贝数等)的纳米新冠疫苗,并探索了这些参数对B细胞活化的影响,在小鼠模型中系统评估了优化后的新冠纳米疫苗的短/长期免疫效果,以及对新冠病毒及其变异株的广谱保护效应。
SARS-CoV-2表面刺突蛋白中的受体结合域(RBD)是新冠病毒与人类细胞相互作用的主要结构域,因为它能诱导产生中和性抗体阻止病毒入侵,避免了因非中和抗体而导致抗体依赖性感染增强的潜在风险,这使得RBD亚基成为最具吸引力的新冠疫苗抗原靶标。然而RBD单体的低分子量和表面价态限制了其免疫原性和疫苗效果。为了提高抗原的大小和表面价态,在纳米颗粒上展示多个抗原拷贝的方法受到广泛的关注。具有高度重复表面模式的纳米颗粒,如病毒样颗粒和铁蛋白,已被用于构建多聚的亚单位纳米疫苗,以改善抗原的淋巴结引流,促进诱导B细胞受体(BCR)交联和激活的能力。然而,目前纳米疫苗的颗粒形态和大小与SARS-CoV-2有明显不同,且均匀重复的表面抗原图案也失去了真实病毒表面的抗原成簇分布特征。因此,提高纳米疫苗与真实病毒的相似性,开发形貌和表面抗原图案可控的纳米载体技术,同时探索表面抗原模式与疫苗疗效之间的构效关系对于新一代抗病毒亚单位疫苗的研发具有重要意义。
DNA折纸技术的出现为解决这一问题带来契机,其形态上的可编程性、表面可寻址性,使其成为在纳米尺度上研究蛋白质的空间排列与生物功能之间关系的理想工具。国家纳米科学中心赵潇/聂广军团队在纳米疫苗递送技术的研发及其作用机制方面已获得一系列进展(Nature Nanotechnology,2024,19,387-398;Nature Biomedical Engineering,2022,6,898-909;Nature Communications 2021,12: 2041;Nature Protocols,2022,17,2240-2274)。该团队前期研究已构建一种“雕刻-印刷”策略,能够快速高效地将功能性蛋白精准修饰到DNA折纸的指定位置(Small 2023,19(23):e2206160)。在该研究基础上,该团队首先利用DNA折纸技术构建了直径约90 nm的二十面体DNA折纸(ICO),接近于SARS-CoV-2的形态和大小(图a)。然后,使用“雕刻-印刷”策略将RBD抗原精确修饰到ICO(ICO-RBD)表面(构建了具有不同参数的多种表面抗原模式,包括抗原间距、抗原簇数以及簇内抗原拷贝数,图a)。利用稳定表达RBD抗原同源IgG受体的B细胞进行体外实验,研究这些参数对B细胞活化的影响,并筛选出具有最佳表面RBD分布模式的纳米疫苗(图b)。最后,在小鼠模型中系统评估了优化后的ICO-RBD纳米疫苗的短/长期免疫效果,并将该纳米疫苗与三聚体mRNA疫苗的免疫效果进行了比较(图b)。ICO纳米载体和优化后的表面抗原模式也适用于展示Omicron RBD,构建的纳米疫苗在体液免疫方面的免疫效果与mRNA疫苗相当,并且具有更强的细胞免疫激活能力(图c)。本研究为纳米疫苗的合理设计提供了参考原则,并验证了DNA折纸作为传染病疫苗展示平台的适用性。基于DNA纳米技术解析的抗原图案与免疫原性之间的结构-功能关系为未来开发针对SARS-CoV-2及其他病毒的强效疫苗奠定了基础。
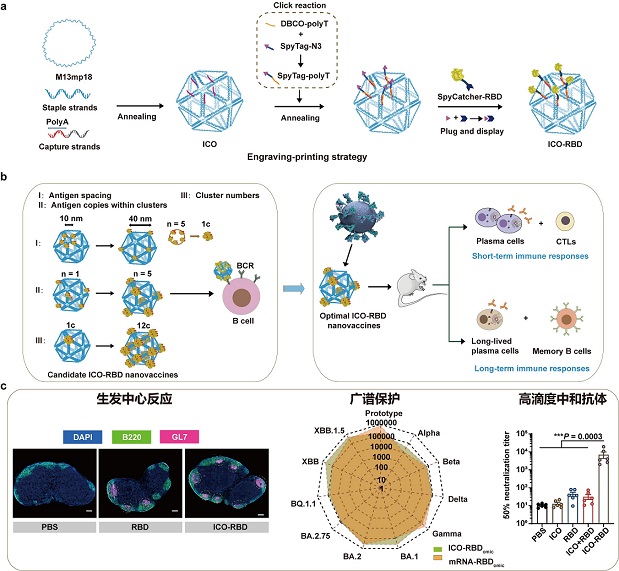
图. ICO-RBD纳米疫苗的设计、构建与疫苗效果评价
国家纳米科学中心的冯晴晴博士、程科满副研究员、张李卓博士和北京生物技术研究所王东澍博士为论文共同第一作者。国家纳米科学中心的赵潇研究员、聂广军研究员和北京生物技术研究所王恒樑研究员为论文通讯作者。该研究得到北京市科委生命科学前沿创新培育专项、国家重点研发计划、国家自然科学基金、中国科学院稳定支持基础研究领域青年团队计划和中国科学院战略性先导科技专项等项目支持。
论文链接:https://www.nature.com/articles/s41467-024-53937-4