



信使RNA(mRNA)药物的显著进展正在深刻变革疾病治疗策略。其中,开发mRNA递送系统已成为生物医学领域的前沿研究方向与关注焦点。尽管现有递送系统已在mRNA负载、细胞摄取及促进溶酶体逃逸等关键环节取得一定进展,但仍面临三大技术瓶颈:1)需摒弃传统依赖静电相互作用的基因装载模式;2)需实现高效胞质递送与翻译(目前仅1-2%的mRNA能够有效逃逸至胞质,严重限制蛋白表达效率);3)稳定性与保存性能亟待提升。因此,针对mRNA递送全过程进行优化,以提高其胞质递送与翻译效率,仍是当前研究的重中之重。
国家纳米科学中心陈春英院士团队长期致力于核酸递送载体的开发与应用研究。团队系统开展了mRNA、质粒、miRNA及siRNA等多种核酸分子的递送研究,通过多策略协同显著提升了核酸药物的细胞内递送效率与功能表达,为其临床应用奠定了坚实基础(Sci Adv, 2024, 10(47), eadp3680; Adv Mater, 2020, 2006189; ACS Nano, 2020, 14, 15700; Adv Mater, 2021, 2100556; ACS Nano, 2024, 18, 19232)。近日,团队在Science Bulletin发表题目为: Adjuvant-metal-ion-chelating PTEN mRNA with cell-membrane-coating augments the immune sensitivity for precise cancer immunotherapy的研究论文,创新性地利用金属离子与mRNA之间的弱相互作用实现高效装载,成功构建了一种基于Mn2+螯合与免疫细胞膜包覆的仿生递送系统。该系统通过膜融合介导的胞质直接递送机制,显著增强了mRNA的转染效率。
本研究受金属离子通过弱配位作用辅助mRNA折叠的天然机制启发,从多种免疫佐剂金属离子(Mn2+、Mo4+、Fe2+、Zn2+、Ca2+)中筛选出Mn2+作为最优候选,利用其与PTEN mRNA之间的弱相互作用在温和条件(25℃)下高效结合,形成Mn2+-mRNA复合物,并进一步采用细胞膜包覆。该策略摒弃了传统阳离子脂质依赖静电作用的装载模式,将mRNA装载效率从LNP的95%提升至98%,空载率显著降低(Mn-NP@PM:~10%;LNP:40%-80%),并表现出优于LNP的稳定性。相较于LNP依赖电荷反转介导的溶酶体逃逸,本系统凭借类似外泌体的膜融合机制,实现mRNA直接胞质递送,规避内体-溶酶体途径,显著提高转染效率(细胞水平提高约2倍,肿瘤组织提高约20倍)。
此外,围绕重要肿瘤抑制因子PTEN,本研究基于临床数据构建了结直肠癌PTEN表达关联图谱,建立肿瘤分型模型,并成功识别PTEN治疗敏感人群。该研究为实现PTEN靶向治疗疗效的最大化提供了新策略,也为开发高效mRNA纳米药物开辟了新途径。
国家纳米科学中心特别研究助理郭梦雨、北京中医药大学教授郭津丞、中国科学院高能物理研究所尹浩东、国家纳米科学中心博士生高奋娥为该论文的共同第一作者,刘晶研究员、陈春英院士为该论文共同通讯作者。本研究工作得到新基石研究员项目、基础科学中心项目、国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项 (B类)、中国医学科学院创新工程、北京市自然科学基金等项目的资助。
论文链接:https://www.sciencedirect.com/science/article/pii/S2095927325011247
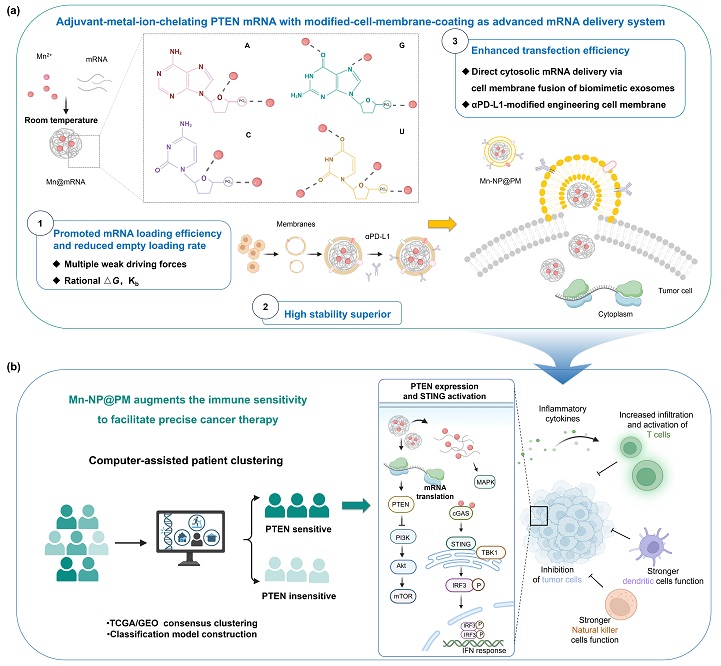
金属离子螯合PTEN mRNA仿生递送系统用于精准癌症免疫治疗